名校
解题方法
1 . 氮化钙有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是_______ 。
(2)装置A中每生成标准状况下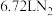 ,转移的电子数为
,转移的电子数为_______ 。
(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为_______ 。
(4)设计实验证明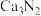 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:_______ 。
II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?_______ (填“是”或“否”),理由是_______ 。
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。
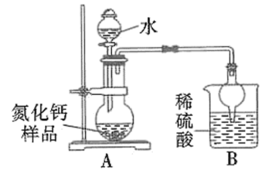
①该样品中氮化钙的质量分数为_______ 。
②导致该样品中氮化钙含量测定结果偏低的可能原因是_______ 。
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是
(2)装置A中每生成标准状况下
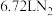 ,转移的电子数为
,转移的电子数为(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为
(4)设计实验证明
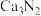 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。

①该样品中氮化钙的质量分数为
②导致该样品中氮化钙含量测定结果偏低的可能原因是
您最近一年使用:0次
2021-09-16更新
|
255次组卷
|
3卷引用:内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题
名校
解题方法
2 . I.碳、硫的含量对钢铁性能影响很大,其含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。实验流程如图:
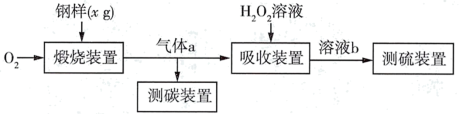
(1)煅烧装置中采用纯氧,目的是_______ 。气体a的主要成分有_____ 、CO2和未反应的O2。
(2)为充分吸收气体a,下列吸收装置中合适的是______ (填标号)。
A.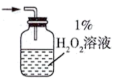 B.
B.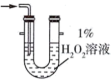
C.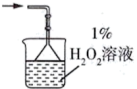 D.
D.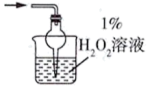
(3)气体a被 溶液吸收转化为硫酸(溶液b),用已知浓度的
溶液吸收转化为硫酸(溶液b),用已知浓度的 溶液滴定生成的溶液b,根据消耗
溶液滴定生成的溶液b,根据消耗 溶液的体积可确定钢样中硫的质量分数。
溶液的体积可确定钢样中硫的质量分数。
①滴定时 溶液置于
溶液置于_____ (填仪器名称)中,若以酚酞为指示剂,终点时的现象为_______ 。
②若称取1 g钢样进行实验,滴定消耗 溶液
溶液 ,则该钢样中硫的质量分数为
,则该钢样中硫的质量分数为_____ 。
(4)若将气体a通入以下测碳装置中(如图),采用重量法测定碳的含量。
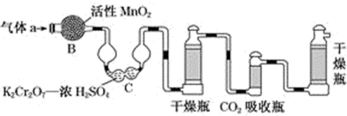
①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是______ 。
②计算钢样中碳的质量分数,应测量的数据是_______ 。
II.回答下列问题:
(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是______ (填标号)
A.Al B.Al2O3C.CuO D.NaHCO3
SiO2还能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为________ 。
(2)电弧炉中生成粗硅,反应的化学方程式为_______ 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为___________ 。

(1)煅烧装置中采用纯氧,目的是
(2)为充分吸收气体a,下列吸收装置中合适的是
A.
 B.
B.
C.
 D.
D.
(3)气体a被
 溶液吸收转化为硫酸(溶液b),用已知浓度的
溶液吸收转化为硫酸(溶液b),用已知浓度的 溶液滴定生成的溶液b,根据消耗
溶液滴定生成的溶液b,根据消耗 溶液的体积可确定钢样中硫的质量分数。
溶液的体积可确定钢样中硫的质量分数。①滴定时
 溶液置于
溶液置于②若称取1 g钢样进行实验,滴定消耗
 溶液
溶液 ,则该钢样中硫的质量分数为
,则该钢样中硫的质量分数为(4)若将气体a通入以下测碳装置中(如图),采用重量法测定碳的含量。

①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是
②计算钢样中碳的质量分数,应测量的数据是
II.回答下列问题:
(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是
A.Al B.Al2O3C.CuO D.NaHCO3
SiO2还能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为
(2)电弧炉中生成粗硅,反应的化学方程式为
您最近一年使用:0次
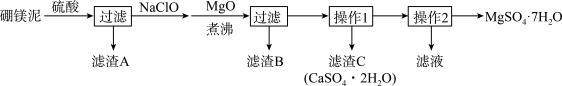
3 . 七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___ 。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___ 。
(3)加入MgO后,加热煮沸的目的是___ 。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___ 。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___ 。
(6)获取MgSO4·7H2O的操作2为:___ 、___ 、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___ (能或不能),表达式(或理由)为___ 。

已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
| 温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(2)滤渣A中除含少量CaSO4·2H2O外,还有
(3)加入MgO后,加热煮沸的目的是
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止
(6)获取MgSO4·7H2O的操作2为:
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。
您最近一年使用:0次
2020-04-04更新
|
355次组卷
|
3卷引用:内蒙古呼伦贝尔市海拉尔区2020届高三上学期第一次模拟统一考试理科综合化学试题
名校
4 . 下列关于碱金属及其化合物的叙述错误的是
| A.金属钠投入Ca(HCO3)2溶液,反应后有白色沉淀析出 |
| B.干粉灭火器能用于扑灭金属钠、钾的着火 |
| C.生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl |
| D.Na-K合金用作快中子反应堆的导热剂 |
您最近一年使用:0次
解题方法
5 . 将50 g质量分数为w1、物质的量浓度为c1的浓硫酸加入V mL水(水的密度为1 g/cm3)中,稀释后得到质量分数为w2、物质的量浓度为c2的稀硫酸。下列说法中正确的是
| A.若w1=2w2,则V>50 | B.若w1=2w2,则V<50 |
| C.若c1=2c2,则V>50 | D.若c1=2c2,则V<50 |
您最近一年使用:0次
名校
6 . 设 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.12.4g白磷(P4)中所包含的 共价键有 共价键有 |
B. 的 的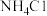 溶液中通入适量氨气后呈中性,此溶液中 溶液中通入适量氨气后呈中性,此溶液中 数目为 数目为 |
C.向含有 的溶液中通入适量氯气,当有 的溶液中通入适量氯气,当有 被氧化时,该反应转移电子数目为 被氧化时,该反应转移电子数目为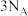 |
D.10g环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,其中所含的氧原子数目为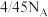 |
您最近一年使用:0次
2022-10-29更新
|
307次组卷
|
3卷引用:内蒙古赤峰二中2023届高三上学期10月第二次月考化学试题
内蒙古赤峰二中2023届高三上学期10月第二次月考化学试题内蒙古赤峰二中2022-2023学年高三上学期第二次月考化学试题 (已下线)专题02 阿伏加德罗常数及其化学计算 (练)-2023年高考化学二轮复习讲练测(新高考专用)
7 . 二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶的低温硫化剂和粘结剂。查阅资料可知S2Cl2具有下列性质:
(1)实验室可利用硫与少量氯气在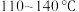 反应制得S2Cl2粗品。
反应制得S2Cl2粗品。
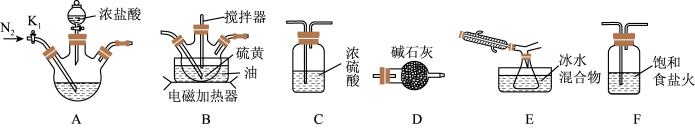
①写出适合A装置制取氯气的离子方程式_______ 。
②请补充完整实验装置连接顺序:A→_______ →D(填写装置标号),其中装置D的作用是_______ 。
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通入氮气,则S2Cl2的产率将_______ (填“偏高”、“偏低”或“无影响”)。
④实验中采用电磁加热方式,而不用酒精灯加热的主要原因是_______ 。实验中为了提高S2Cl2的纯度,实验的关键是控制好温度和_______ 。
(2) S2Cl2遇水强烈反应会产生两种气体和一种沉淀,请写出该反应的化学方程式_______ 。
(3)某同学检验S2Cl2是否含有SCl2杂质进行如下实验:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、 溶液,过滤。
溶液,过滤。
②往①的滤液中加入足量 溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
则产品中氯元素的质量分数为_____ ,由此可知产品中_____ (填“含有”或“不含有”) SCl2杂质。
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | ①300℃以上完全分解 ②氯气过量发生反应: 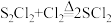 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
 反应制得S2Cl2粗品。
反应制得S2Cl2粗品。
①写出适合A装置制取氯气的离子方程式
②请补充完整实验装置连接顺序:A→
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通入氮气,则S2Cl2的产率将
④实验中采用电磁加热方式,而不用酒精灯加热的主要原因是
(2) S2Cl2遇水强烈反应会产生两种气体和一种沉淀,请写出该反应的化学方程式
(3)某同学检验S2Cl2是否含有SCl2杂质进行如下实验:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、
 溶液,过滤。
溶液,过滤。②往①的滤液中加入足量
 溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
溶液,过滤、洗涤、干燥,称得固体质量为2.87g。则产品中氯元素的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 通过测定混合气中 含量可计算已变质的
含量可计算已变质的 (含
(含 )纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是
)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是
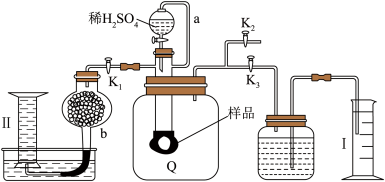
 含量可计算已变质的
含量可计算已变质的 (含
(含 )纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是
)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是
A.Q气囊中产生的气体主要成分为 、 、 |
B.测定气体总体积必须关闭 、 、 ,打开 ,打开 |
C.读完气体总体积后,关闭 ,缓缓打开 ,缓缓打开 ,可观察到Q气囊慢慢缩小 ,可观察到Q气囊慢慢缩小 |
| D.量筒I用于测二氧化碳的量,干燥管b中装入碱石灰,量筒Ⅱ用于测氧气的量 |
您最近一年使用:0次
2023-10-08更新
|
187次组卷
|
5卷引用:内蒙古部分名校2023-2024学年高三上学期期中联合考试化学试题
9 . DCCNa( )是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。利用NaClO溶液和氰尿酸
)是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。利用NaClO溶液和氰尿酸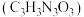 溶液反应制备DCCNa。实验装置如图所示:
溶液反应制备DCCNa。实验装置如图所示:


回答下列问题:
(1)装置Ⅰ中发生反应的化学方程式为
(2)仪器b的名称为
(3)装置Ⅱ中溶液a为
(4)当装置Ⅲ中的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,其原因是
(5)装置Ⅳ中的试剂可选用
a.
 b.NaCl c.
b.NaCl c. d.
d.
(6)反应结束后,装置Ⅲ中三颈烧瓶内的浊液经过滤、
(7)有效氯含量是判断产品质量的标准。通过下列方法测定有效氯含量的原理为:
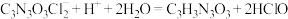


准确称取1.2000g样品,配成250mL溶液。取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min,用
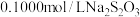 标准溶液滴定至溶液呈微黄色,加入淀粉溶液作指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉溶液作指示剂继续滴定至终点,消耗 溶液20.00mL。该样品的有效氯为
溶液20.00mL。该样品的有效氯为已知:该样品的有效氯

您最近一年使用:0次
2024-03-26更新
|
120次组卷
|
2卷引用:2024届内蒙古自治区赤峰市高三一模化学试题
10 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.过量的铜与含0.2 mol HNO3的浓硝酸反应,转移电子的数目大于0.1NA |
| B.100 g质量分数17%H2O2溶液中含有H—O键数目为NA |
| C.标准状况下,11.2 L的HF中所含分子数为0.5NA |
| D.在K37C1O3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若反应中电子转移的数目为10NA则有420 g氯气生成 |
您最近一年使用:0次
2020-12-02更新
|
123次组卷
|
2卷引用:内蒙古乌兰浩特市四中2022-2023 学年高三上学期第三次月考化学试题



