1 . 铟(In)是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铅、锌的冶炼过程中产生的高铟烟灰(主要含ZnO、PbO、Fe2O3、In2O3、In2S3)中提取铟的流程如图:

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是____ 。
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是____ (用化学方程式表示)。
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有____ (填化学式)。
(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=____ (已知lg19=1.28忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为____ mol•L-1。

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为____ 。

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO
 ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为
您最近一年使用:0次
2022-10-29更新
|
608次组卷
|
3卷引用:吉林省延边第二中学2022-2023学年高三上学期10月月考化学试题
2 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
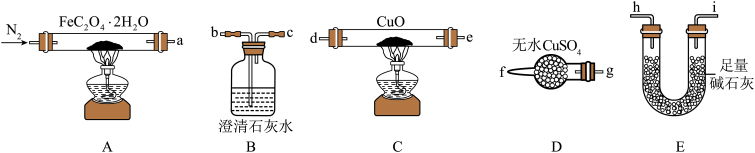
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___ →尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为__ 。
③实验证明了气体产物中含有CO,依据的实验现象为__ 。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是__ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为__ 。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为__ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为__ ;步骤3中加入锌粉的目的为___ 。
(5)若步骤 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将__ (填“偏高”、“偏低”或“不变”)
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:

①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→
②检查装置气密性后,先通入一段时间N2,其目的为
③实验证明了气体产物中含有CO,依据的实验现象为
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为
(5)若步骤
 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
2020-06-12更新
|
1222次组卷
|
3卷引用:吉林省延边州2020届高三4月教学质量检测理科综合化学试题
解题方法
3 . 某种硬铝合金是由 Al、Cu、Mg三种金属组成,主要应用于耐热可焊的结构件及锻件。某研究小组欲探究该合金的性质并测定合金中铝的质量分数:
(1)甲同学预测:该合金与10 mol/L硝酸反应时有NO2气体生成,可能还有NO生成。
查阅资料:常温下,NO2与N2O4混合存在,在低于0 ℃时几乎只有无色的N2O4液体或晶体存在。设计如下装置进行实验。按下图连接装置并检验气密性后,称取5 g 合金放于圆底烧瓶中,并滴加10 mol/L硝酸。

①合金中Cu与稀硝酸反应的离子方程式是 。
②C装置的目的是 。
③能证明有NO生成的实验操作与现象是 。
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10 mol/L硝酸反应时没有NO生成。乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是 。
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
pH > 7.8时,Al(OH)3开始溶解,pH > 10.8时沉淀完全溶解。
设计如下方案并进行实验:

①调节pH时,应控制pH的范围是 。
②选用NaOH溶液调节pH,得到溶液B的离子方程式是 。
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是 。
(1)甲同学预测:该合金与10 mol/L硝酸反应时有NO2气体生成,可能还有NO生成。
查阅资料:常温下,NO2与N2O4混合存在,在低于0 ℃时几乎只有无色的N2O4液体或晶体存在。设计如下装置进行实验。按下图连接装置并检验气密性后,称取5 g 合金放于圆底烧瓶中,并滴加10 mol/L硝酸。

①合金中Cu与稀硝酸反应的离子方程式是 。
②C装置的目的是 。
③能证明有NO生成的实验操作与现象是 。
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10 mol/L硝酸反应时没有NO生成。乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是 。
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
| 金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |
设计如下方案并进行实验:

①调节pH时,应控制pH的范围是 。
②选用NaOH溶液调节pH,得到溶液B的离子方程式是 。
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是 。
您最近一年使用:0次
名校
4 . 8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
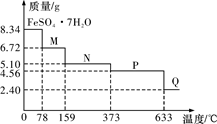

| A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O |
| B.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4 |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O FeSO4+H2O FeSO4+H2O |
| D.温度为159 ℃时固体N的化学式为FeSO4·2H2O |
您最近一年使用:0次
2016-12-09更新
|
3465次组卷
|
10卷引用:吉林省延边第二中学2020届高三上学期第一次调研化学试题



