1 . N元素的单质及其化合物之间的转化关系如图所示:NH3←N2→NO→NO2→HNO3
回答下列问题:
(1)N元素在元素周期表中的位置为第___ 周期,第___ 族;画出N原子结构示意图___ 。
(2)工业上用氮气和氢气合成氨气,请写出NH3的电子式___ 。
(3)实验室可以利用氢氧化钙固体和氯化铵固体制备氨气,请写出该反应的化学反应方程式___ ;并写出实验室检验氨气的具体操作___ 。
(4)NO是治疗心血管疾病的信使分子,NO与空气接触的反应现象是___ ,写出该反应的化学方程式___ ,若该反应转移0.4mole-,则消耗的NO分子数是___ (用NA表示阿伏加 德罗常数)。
(5)浓硝酸具有不稳定性,实验室应该将浓硝酸保存在带玻璃塞的___ (填“无色”或“棕色”)试剂瓶中。
回答下列问题:
(1)N元素在元素周期表中的位置为第
(2)工业上用氮气和氢气合成氨气,请写出NH3的电子式
(3)实验室可以利用氢氧化钙固体和氯化铵固体制备氨气,请写出该反应的化学反应方程式
(4)NO是治疗心血管疾病的信使分子,NO与空气接触的反应现象是
(5)浓硝酸具有不稳定性,实验室应该将浓硝酸保存在带玻璃塞的
您最近半年使用:0次
名校
解题方法
2 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
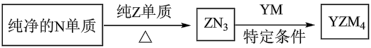
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近半年使用:0次
名校
解题方法
3 . 已知短周期元素M、N、X、Y、Z分布在三个周期。N、X最外层电子数相同,2原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是___________ ,写出YM的电子式:___________ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)镓( )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是___________ (填字母)。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”,氮化镓可用于制作电子产品的充电器
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
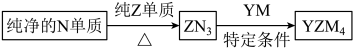
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
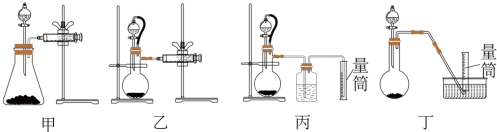
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(
 )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”,氮化镓可用于制作电子产品的充电器
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则
 样品纯度为
样品纯度为
您最近半年使用:0次
名校
4 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_____ ;N的简单离子的核外电子排布示意图为_____ 。
(2)用电子式表示化合物YN的形成过程:_____ 。
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取Y3ZX6的一种方法,写出该反应的化学方程式:_____ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_____ (填字母)。
a.Ga位于元素周期表第四周期IVA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出NO2气体,同时生成H3AsO4和Ga(NO3)3,写出该反应的化学方程式:_____ 。
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示。
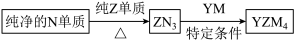
特定条件利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①YZM4遇水反应的化学方程式为_____ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_____ (填编号)。
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则YZM4样品纯度为_____ (用代数式表示)。
(1)Y在周期表中的位置是
(2)用电子式表示化合物YN的形成过程:
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取Y3ZX6的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期IVA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出NO2气体,同时生成H3AsO4和Ga(NO3)3,写出该反应的化学方程式:
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示。

特定条件利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①YZM4遇水反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则YZM4样品纯度为
您最近半年使用:0次
名校
解题方法
5 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
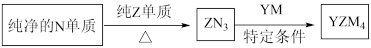
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近半年使用:0次
名校
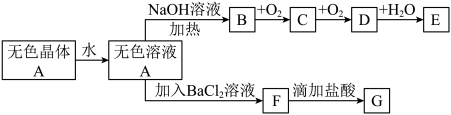
6 . A是由四种短周期常见元素组成的正盐,D是红棕色气体、G能使品红溶液褪色;A与其他物质在一定条件下存在如下转化关系(部分产物略去):
试回答下列问题:
(1)A、E的化学式依次为_____ 、_____ 。
(2)B、C、D、E中都含有一种相同的元素,其在元素周期表中的位置是_______ 。
(3)写出下列反应对应的方程式:
①D→E的化学方程式:_____ 。
②F→G的离子方程式:______ 。
(4)E的浓溶液与B反应,可观察到______ 。

试回答下列问题:
(1)A、E的化学式依次为
(2)B、C、D、E中都含有一种相同的元素,其在元素周期表中的位置是
(3)写出下列反应对应的方程式:
①D→E的化学方程式:
②F→G的离子方程式:
(4)E的浓溶液与B反应,可观察到
您最近半年使用:0次
名校
解题方法
7 . 如图为元素周期表的一部分,请根据元素①~⑧在表中的位置,回答下列问题:

(1)请写出元素⑦在元素周期表中的位置
(2)由元素⑤形成的化合物Na3N遇水反应生成氨气(NH3)和一种强碱,该反应的化学方程式为
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是
(4)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为氢氧化钠,所有反应都在溶液中进行。反应①的离子方程式为
您最近半年使用:0次
名校
解题方法
8 .  、
、 、
、 、
、 、
、 五种元素中,
五种元素中, 、
、 、
、 、
、 为原子序数依次增大的短周期主族元素,
为原子序数依次增大的短周期主族元素, 的电子层数等于其最外层电子数且在同周期中
的电子层数等于其最外层电子数且在同周期中 的原子半径最小,
的原子半径最小, 、
、 、
、 元素的常见单质均为气体、其中
元素的常见单质均为气体、其中 、
、 的单质是空气的主要成分,
的单质是空气的主要成分, 与其他元素不在同一周期,
与其他元素不在同一周期, 为常见使用量最大的金属,在一定条件下,
为常见使用量最大的金属,在一定条件下, 的单质可以分别与
的单质可以分别与 、
、 的单质化合生成甲、乙。各物质间有如图转化关系,回答下列问题:
的单质化合生成甲、乙。各物质间有如图转化关系,回答下列问题:
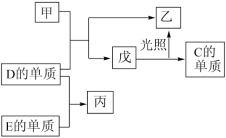
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)写出
 的单质的电子式:
的单质的电子式:(3)戊的分子中
 元素的化合价为
元素的化合价为(4)
 、
、 、
、 三种元素的原子半径从大到小的顺序为
三种元素的原子半径从大到小的顺序为(5)钠在
 的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为
的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为(6)丙具有很强的氧化性,丙的饱和溶液可以将
 的单质溶解,试写出丙与
的单质溶解,试写出丙与 反应的离子方程式:
反应的离子方程式:
您最近半年使用:0次
名校
解题方法
9 . 如图为元素周期表的一部分,请根据元素①~⑧在表中的位置,回答下列问题:

(1)请写出元素⑦在元素周期表中的位置___________ 。在上述元素的最高价氧化物对应的水化物中,酸性最强的是___________ (用化学式表示)。
(2)由元素①、④、⑤形成的化合物的电子式为___________ ,该物质属于___________ (填“离子”或“共价”)化合物。
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:___________ 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
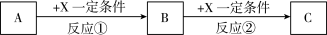
若A、B、C含同一金属元素,X为电解质溶液,可电离出 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为___________ ,X的化学式为___________ 。

(1)请写出元素⑦在元素周期表中的位置
(2)由元素①、④、⑤形成的化合物的电子式为
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为电解质溶液,可电离出
 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为
您最近半年使用:0次
名校
10 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。

利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近半年使用:0次
2022-07-29更新
|
1145次组卷
|
3卷引用:湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题
湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)



