解题方法
1 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
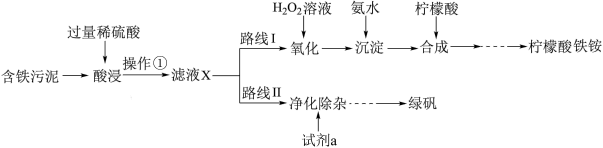
根据所学知识,回答下列问题:
(1)操作①的名称是_______ ,路线I中,加入H2O2溶液的目的是_______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:_______ ;检验含有Fe3+的试剂是_______ 。
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_______ 。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
(5)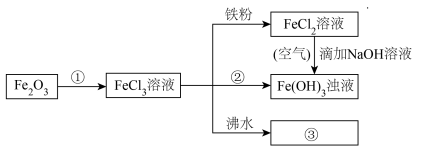
FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是_______ 。

根据所学知识,回答下列问题:
(1)操作①的名称是
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
(5)

FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是
您最近半年使用:0次
名校
解题方法
2 . 某实验小组以含铁污泥(主要成分为 、
、 、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。

根据所学知识,回答下列问题:
(1)路线Ⅰ中,加入 溶液发生的离子反应方程式是
溶液发生的离子反应方程式是__________ 。
(2)写出“酸浸”时, 与硫酸反应的化学方程式:
与硫酸反应的化学方程式:__________ ;检验含有 的方法是
的方法是__________ 。
(3)“滤液X”中一定含有的阳离子为__________ 。
(4)实验室中配制 溶液时通常需加入少量的试剂a,目的是
溶液时通常需加入少量的试剂a,目的是__________ ,请写出相应的离子方程式:__________ 。
 、
、 、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
根据所学知识,回答下列问题:
(1)路线Ⅰ中,加入
 溶液发生的离子反应方程式是
溶液发生的离子反应方程式是(2)写出“酸浸”时,
 与硫酸反应的化学方程式:
与硫酸反应的化学方程式: 的方法是
的方法是(3)“滤液X”中一定含有的阳离子为
(4)实验室中配制
 溶液时通常需加入少量的试剂a,目的是
溶液时通常需加入少量的试剂a,目的是
您最近半年使用:0次
解题方法
3 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
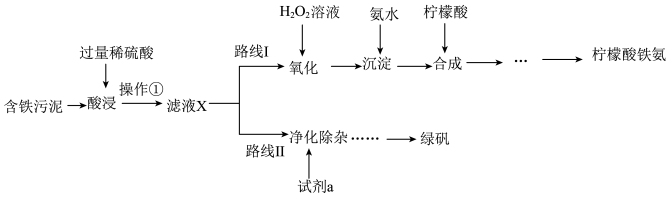
根据所学知识,回答下列问题:
(1)操作①的名称______ ,路线I中,加入H2O2溶液的目的是______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:______ ;检验含有Fe3+的方法是______ 。
(3)“滤液X”中一定含有的阳离子为_______ 。
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_____ ,请写出相应的离子方程式:______ 。

根据所学知识,回答下列问题:
(1)操作①的名称
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)“滤液X”中一定含有的阳离子为
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
您最近半年使用:0次
名校
解题方法
4 . 按要求回答下列问题:
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:__________________________________________ ;若将此混合溶液置于50℃的水浴中,则出现浑浊的时间将__________ (填“增加”、“减少”或“不变”)。
(2)已知 的电离平衡常数
的电离平衡常数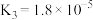 ,向0.1mol/L
,向0.1mol/L 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至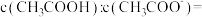 1:18,此时溶液PH=
1:18,此时溶液PH=________ 。
(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
则该反应的热化学反应方程式为:___________________________ 。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______ (填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_________________________________ 。

(4)已知2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________ 。
③达到平衡后CH3OH的浓度为_____________ 。
(5)制取聚乙二酸乙二酯的反应方程式_______________________________
(6)有一种耐热型树脂材料的结构简式为 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________ 。
(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为_________ 。
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用❉标注。
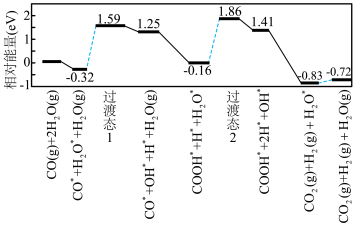
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_______________________ 。
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:_________________________
(10)已知: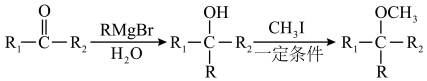 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以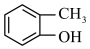 为原料制备
为原料制备 的合成路线(提供CH3MgBr及需要的无机试剂)
的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________ 。
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:
(2)已知
 的电离平衡常数
的电离平衡常数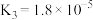 ,向0.1mol/L
,向0.1mol/L 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至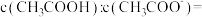 1:18,此时溶液PH=
1:18,此时溶液PH=(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是

(4)已知2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.4 | 0.1 | 0.1 |
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为
③达到平衡后CH3OH的浓度为
(5)制取聚乙二酸乙二酯的反应方程式
(6)有一种耐热型树脂材料的结构简式为
 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用❉标注。

可知水煤气变换的ΔH
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:
(10)已知:
 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以 为原料制备
为原料制备 的合成路线(提供CH3MgBr及需要的无机试剂)
的合成路线(提供CH3MgBr及需要的无机试剂)
您最近半年使用:0次
名校
5 .  、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用 可合成多种化工产品。
可合成多种化工产品。
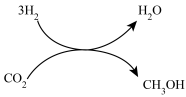
2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为___________ 。
②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为___________ 。过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇( )实现
)实现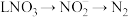 的转化,将
的转化,将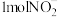 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为___________ 。
(3)硫酸生产及煤燃烧过程中产生的废气 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于___________ (填“电解质”或“非电解质”),氨水吸收少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
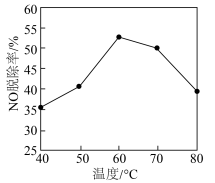
(4)氮的氧化物(NO、 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________ 。
 、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用
 可合成多种化工产品。
可合成多种化工产品。2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现
 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为 )实现
)实现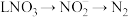 的转化,将
的转化,将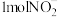 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为(3)硫酸生产及煤燃烧过程中产生的废气
 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于 ,反应的离子方程式为
,反应的离子方程式为(4)氮的氧化物(NO、
 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
您最近半年使用:0次
名校
解题方法
6 . 已知短周期元素M、N、X、Y、Z分布在三个周期。N、X最外层电子数相同,2原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是___________ ,写出YM的电子式:___________ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)镓(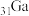 )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是___________ (填字母)。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”,氮化镓可用于制作电子产品的充电器
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性: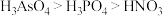
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
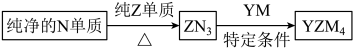
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
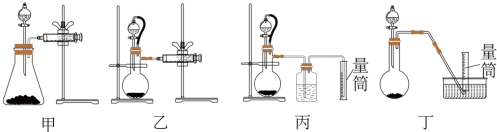
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(
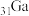 )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”,氮化镓可用于制作电子产品的充电器
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
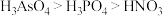
(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则
 样品纯度为
样品纯度为
您最近半年使用:0次
名校
7 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_____ ;N的简单离子的核外电子排布示意图为_____ 。
(2)用电子式表示化合物YN的形成过程:_____ 。
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取Y3ZX6的一种方法,写出该反应的化学方程式:_____ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_____ (填字母)。
a.Ga位于元素周期表第四周期IVA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出NO2气体,同时生成H3AsO4和Ga(NO3)3,写出该反应的化学方程式:_____ 。
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示。
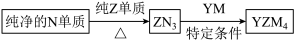
特定条件利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①YZM4遇水反应的化学方程式为_____ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_____ (填编号)。
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则YZM4样品纯度为_____ (用代数式表示)。
(1)Y在周期表中的位置是
(2)用电子式表示化合物YN的形成过程:
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取Y3ZX6的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期IVA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出NO2气体,同时生成H3AsO4和Ga(NO3)3,写出该反应的化学方程式:
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示。

特定条件利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①YZM4遇水反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为VmL(标准状态),则YZM4样品纯度为
您最近半年使用:0次
名校
解题方法
8 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如图所示:
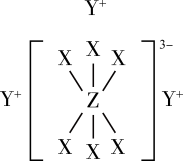
回答下列问题:
(1)Y、Z元素的中文名称为徐寿确定并使用至今,Y在周期表中的位置是___________ ,写出YM的电子式:___________ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在YZO2,与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:___________ 。
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。废弃的含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3,其中硝酸被还原为NO2写出该反应的化学方程式为___________ 。
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示: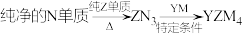 ,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。
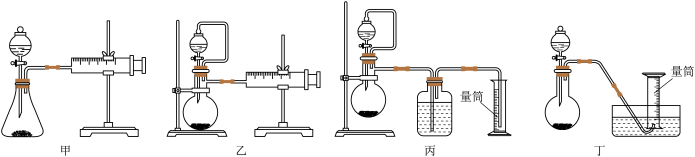
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则YZM4样品纯度为___________ (用代数式表示)。

回答下列问题:
(1)Y、Z元素的中文名称为徐寿确定并使用至今,Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在YZO2,与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。废弃的含GaAs的半导体材料可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3,其中硝酸被还原为NO2写出该反应的化学方程式为
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示:
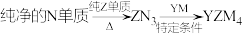 ,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
,利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则YZM4样品纯度为
您最近半年使用:0次
名校
解题方法
9 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:
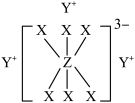
回答下列问题:
(1)请写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是_______ 。
a. Ga位于元素周期表第四周期IVA族
b. GaN为新型无机非金属材料
c. Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d. 酸性:H3AsO4>H3PO4>HNO3
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示

利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。
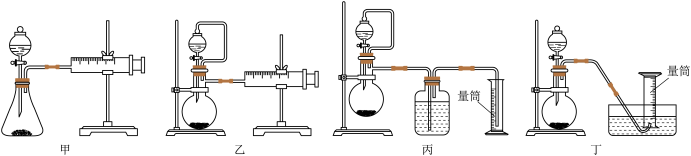
从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品ag,若实验测得氢气的体积为V L(标准状态),则YZM4样品纯度为_______ (用代数式表示)。

回答下列问题:
(1)请写出YM的电子式:
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
a. Ga位于元素周期表第四周期IVA族
b. GaN为新型无机非金属材料
c. Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d. 酸性:H3AsO4>H3PO4>HNO3
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示

利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为V L(标准状态),则YZM4样品纯度为
您最近半年使用:0次
名校
10 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取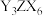 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性: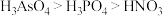
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。

利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取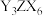 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
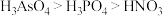
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近半年使用:0次
2022-07-29更新
|
1145次组卷
|
3卷引用:湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题
湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)



