名校
1 .  、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用 可合成多种化工产品。
可合成多种化工产品。
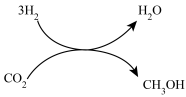
2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为___________ 。
②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为___________ 。过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇( )实现
)实现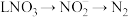 的转化,将
的转化,将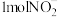 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为___________ 。
(3)硫酸生产及煤燃烧过程中产生的废气 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于___________ (填“电解质”或“非电解质”),氨水吸收少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
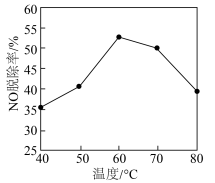
(4)氮的氧化物(NO、 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________ 。
 、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用
 可合成多种化工产品。
可合成多种化工产品。2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现
 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为 )实现
)实现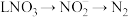 的转化,将
的转化,将 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为(3)硫酸生产及煤燃烧过程中产生的废气
 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于 ,反应的离子方程式为
,反应的离子方程式为(4)氮的氧化物(NO、
 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
您最近半年使用:0次
名校
解题方法
2 . 氯化亚铜是一种应用较广的催化剂,易水解,微溶于水,不溶于乙醇。以低品位铜矿砂(主要成分 )为原料制备氯化亚铜的路线如下:
)为原料制备氯化亚铜的路线如下:
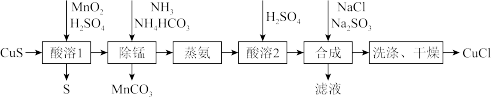
(1)“酸溶1”步骤中发生反应的化学方程式为_______ 。
(2)“除锰”步骤中 转化为
转化为 沉淀,
沉淀, 转变为
转变为 留在溶液中。则“除锰”步骤中发生反应的离子方程式为
留在溶液中。则“除锰”步骤中发生反应的离子方程式为_______ 。
(3)“合成”步骤加入 的速率不宜过快,否则会产生
的速率不宜过快,否则会产生_______ 气体(写化学式),除可能与酸溶时硫酸过量有关,还可能的原因是_______ 。(用离子方程式表示)
(4)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇洗涤除可洗去杂质,减少 的溶解外,还可以
的溶解外,还可以_______ 。
 )为原料制备氯化亚铜的路线如下:
)为原料制备氯化亚铜的路线如下: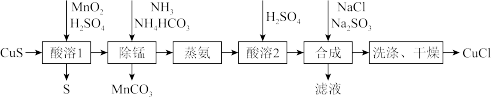
(1)“酸溶1”步骤中发生反应的化学方程式为
(2)“除锰”步骤中
 转化为
转化为 沉淀,
沉淀, 转变为
转变为 留在溶液中。则“除锰”步骤中发生反应的离子方程式为
留在溶液中。则“除锰”步骤中发生反应的离子方程式为(3)“合成”步骤加入
 的速率不宜过快,否则会产生
的速率不宜过快,否则会产生(4)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇洗涤除可洗去杂质,减少
 的溶解外,还可以
的溶解外,还可以
您最近半年使用:0次
2021-04-17更新
|
285次组卷
|
2卷引用:江苏省天一中学2020-2021学年高一下学期期中考试(强化班)化学试题
3 . 氯化亚铜是一种应用较广的催化剂,易水解。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下:
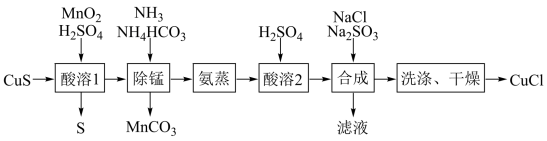
(1)酸溶1步骤中加入MnO2的作用是______ 。
(2)除锰步骤Mn2+转化为MnCO3沉淀,该反应的离子方程式为______ 。溶液中CuSO4转变为Cu(NH3)4CO3留在溶液中。
(3)蒸氨步骤会得到CuO固体,该步骤在减压条件下进行的原因是______ 。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生SO2气体,除可能与酸溶时硫酸过量有关,还可能的原因是______ 。
(5)有工艺将合成步骤的NaCl与Na2SO3换为NH4Cl和(NH4)2SO3,则可获得一种可作为氮肥的副产品,其化学式为_____ 。
(6)洗涤步骤先用______ 洗,再用无水乙醇洗涤。

(1)酸溶1步骤中加入MnO2的作用是
(2)除锰步骤Mn2+转化为MnCO3沉淀,该反应的离子方程式为
(3)蒸氨步骤会得到CuO固体,该步骤在减压条件下进行的原因是
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生SO2气体,除可能与酸溶时硫酸过量有关,还可能的原因是
(5)有工艺将合成步骤的NaCl与Na2SO3换为NH4Cl和(NH4)2SO3,则可获得一种可作为氮肥的副产品,其化学式为
(6)洗涤步骤先用
您最近半年使用:0次
2019高三下·江苏·专题练习
解题方法
4 . 氯化亚铜是一种应用较广的催化剂,易水解,微溶于水,不溶于乙醇和稀硫酸;在空气中迅速被氧化成绿色;见光易分解变成褐色。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下:

回答下列问题:
(1)“酸溶1”过程中发生反应的化学方程式是________ 。
(2)“除锰”过程中加入NH3·H2O的目的是________ 。
(3)“酸溶2”步骤加入的硫酸略过量的原因是________ 。
(4)“合成”步骤反应的离子方程式是________ 。
(5)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇的目的是________ 。
(6)在CuCl的生产过程中除环境问题和安全问题外,还应该注意的关键问题是________ 。

回答下列问题:
(1)“酸溶1”过程中发生反应的化学方程式是
(2)“除锰”过程中加入NH3·H2O的目的是
(3)“酸溶2”步骤加入的硫酸略过量的原因是
(4)“合成”步骤反应的离子方程式是
(5)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇的目的是
(6)在CuCl的生产过程中除环境问题和安全问题外,还应该注意的关键问题是
您最近半年使用:0次
5 . 2021年9月28日,国务院新闻办公室发表《中国的全面小康》白皮书,宣布中国全面进入小康社会。化学学科正以独特学科价值为全面小康社会保驾护航。
I.屠呦呦制备青蒿素是高效的抗疟药。青蒿素为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点为35℃,乙醚浸取法是从青蒿中提取青蒿素的方法。其主要工艺如图所示:
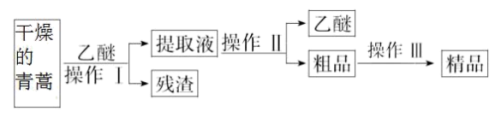
(1)乙醚浸取青蒿时,为增大青蒿素的浸出率,可采取的措施是___________ 。
(2)操作I需要的玻璃仪器主要有烧杯、玻璃棒、_____ ,操作II的名称是_______ 。
(3)操作III的主要过程可能是___________ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
II.我国正努力争取2060年前实现碳中和,用化学手段实现碳中和主要是对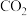 进行捕获收集和资源化利用。
进行捕获收集和资源化利用。
(4)利用低浓度氨水吸收烟气中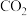 生成
生成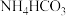 ,其离子方程式为
,其离子方程式为___________ 。
(5)下列说法有利于实现碳中和的是___________ 。
A.积极鼓励植树造林,降低空气中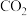 含量
含量
B.研发利用二氧化碳合成淀粉的人工路线,实现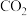 的资源化利用
的资源化利用
C.开发可燃冰(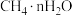 )作为新的替代能源
)作为新的替代能源
I.屠呦呦制备青蒿素是高效的抗疟药。青蒿素为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点为35℃,乙醚浸取法是从青蒿中提取青蒿素的方法。其主要工艺如图所示:

(1)乙醚浸取青蒿时,为增大青蒿素的浸出率,可采取的措施是
(2)操作I需要的玻璃仪器主要有烧杯、玻璃棒、
(3)操作III的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
II.我国正努力争取2060年前实现碳中和,用化学手段实现碳中和主要是对
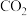 进行捕获收集和资源化利用。
进行捕获收集和资源化利用。(4)利用低浓度氨水吸收烟气中
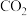 生成
生成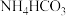 ,其离子方程式为
,其离子方程式为(5)下列说法有利于实现碳中和的是
A.积极鼓励植树造林,降低空气中
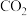 含量
含量B.研发利用二氧化碳合成淀粉的人工路线,实现
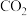 的资源化利用
的资源化利用C.开发可燃冰(
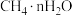 )作为新的替代能源
)作为新的替代能源
您最近半年使用:0次
名校
6 .  、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用 可合成多种化工产品。
可合成多种化工产品。
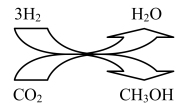
① 与
与 能在催化剂表面反应生成优质气体燃料
能在催化剂表面反应生成优质气体燃料 和
和 ,该反应的化学方程式为
,该反应的化学方程式为__ 。
②2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于___________ (填“电解质”或“非电解质”),标准状况下,1体积水约能溶解 体积
体积 ,所得氨水密度为
,所得氨水密度为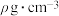 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为___________ 。
②氨水吸收少量 ,可生成
,可生成 ,反应的离子方程式为
,反应的离子方程式为___________ 。所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为___________ 。
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。
可合成多种化工产品。
①
 与
与 能在催化剂表面反应生成优质气体燃料
能在催化剂表面反应生成优质气体燃料 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于 体积
体积 ,所得氨水密度为
,所得氨水密度为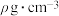 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为②氨水吸收少量
 ,可生成
,可生成 ,反应的离子方程式为
,反应的离子方程式为 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为
您最近半年使用:0次
2022·陕西咸阳·二模
名校
解题方法
7 . 内酯Y可由X通过电解合成,并在一定条件下转化为Z,转化路线如图:


下列说法正确的是


下列说法正确的是
| A.X苯环上的一氯代物一定有9种 |
| B.X→Y的反应类型为还原反应 |
| C.X、Y、Z都能与碳酸氢钠溶液反应. |
| D.X、Y、Z分子中均至少有9个碳原子共面 |
您最近半年使用:0次
2022-08-20更新
|
666次组卷
|
6卷引用:化学-2022年高考考前押题密卷(江苏卷)
(已下线)化学-2022年高考考前押题密卷(江苏卷)陕西省咸阳市2022届高考模拟检测(二模)理科综合化学试题福建省泉州市永春第一中学2021-2022学年高二下学期4月线上考试化学试题山西省太原市第五中学校2022-2023学年高三上学期期末考试化学试题(已下线)狂飙卷 03 -【热题狂飙】2023年高考化学样卷(全国卷专用)湖南衡阳名校2024届高三一轮复习12月第2周周练 化学试题
8 . 铁的化合物在生产生活中应用广泛。工业上用废铁屑或炼铁废渣(主要成分Fe、 和少量CuO)制备硫酸亚铁,以硫酸亚铁为原料制备水处理剂——聚合硫酸铁
和少量CuO)制备硫酸亚铁,以硫酸亚铁为原料制备水处理剂——聚合硫酸铁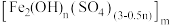 。
。
(1)利用废铁屑(含少量FeS)制备聚合硫酸铁的装置如下(支撑装置略):

①溶解:先用10%的碳酸钠溶液煮沸废铁屑,再用清水洗净,将处理好的铁屑放入装置中,组装仪器,加入适量稀硫酸溶解;硫酸用量不能过多,原因是___________ ;
②合成:待铁屑反应完全后,分批注入氯酸钾溶液并搅拌,放置一段时间;写出 、
、 、
、 搅拌生成
搅拌生成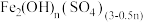 的化学反应方程式
的化学反应方程式___________ 。
③检验:检验甲装置中亚铁离子减少到规定浓度即可结束反应,制得产品。
(2)为了确定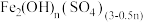 的组成,设计如下实验。
的组成,设计如下实验。
步骤一:取聚合硫酸铁样品25.00mL,加入足量的 溶液,产生白色沉淀,过滤、洗涤、干燥,称重,沉淀质量为2.9125g。
溶液,产生白色沉淀,过滤、洗涤、干燥,称重,沉淀质量为2.9125g。
步骤二:另取25.00mL聚合硫酸铁样品,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液,取该溶液25.00mL,用酸性 溶液滴定,到达终点时用去
溶液滴定,到达终点时用去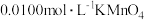 标准溶液20.00mL,求:
标准溶液20.00mL,求: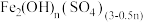 组成。(写出计算过程)
组成。(写出计算过程) ___________
(3)用炼铁废渣制备硫酸亚铁晶体,请补充完整实验方案:
已知:溶液中各离子开始沉淀和沉淀完全的PH值
取一定量的炼铁废渣,加入适量的1.0mol/L硫酸充分溶解,___________ 将滤液蒸发浓缩,冷却结晶,过滤,洗涤,干燥得硫酸亚铁晶体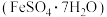 。(必选的试剂
。(必选的试剂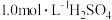 溶液、
溶液、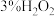 溶液、
溶液、 溶液、还原铁粉)
溶液、还原铁粉)
 和少量CuO)制备硫酸亚铁,以硫酸亚铁为原料制备水处理剂——聚合硫酸铁
和少量CuO)制备硫酸亚铁,以硫酸亚铁为原料制备水处理剂——聚合硫酸铁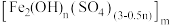 。
。(1)利用废铁屑(含少量FeS)制备聚合硫酸铁的装置如下(支撑装置略):

①溶解:先用10%的碳酸钠溶液煮沸废铁屑,再用清水洗净,将处理好的铁屑放入装置中,组装仪器,加入适量稀硫酸溶解;硫酸用量不能过多,原因是
②合成:待铁屑反应完全后,分批注入氯酸钾溶液并搅拌,放置一段时间;写出
 、
、 、
、 搅拌生成
搅拌生成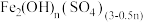 的化学反应方程式
的化学反应方程式③检验:检验甲装置中亚铁离子减少到规定浓度即可结束反应,制得产品。
(2)为了确定
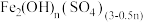 的组成,设计如下实验。
的组成,设计如下实验。步骤一:取聚合硫酸铁样品25.00mL,加入足量的
 溶液,产生白色沉淀,过滤、洗涤、干燥,称重,沉淀质量为2.9125g。
溶液,产生白色沉淀,过滤、洗涤、干燥,称重,沉淀质量为2.9125g。步骤二:另取25.00mL聚合硫酸铁样品,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液,取该溶液25.00mL,用酸性
 溶液滴定,到达终点时用去
溶液滴定,到达终点时用去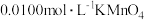 标准溶液20.00mL,求:
标准溶液20.00mL,求: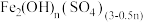 组成。(写出计算过程)
组成。(写出计算过程) (3)用炼铁废渣制备硫酸亚铁晶体,请补充完整实验方案:
已知:溶液中各离子开始沉淀和沉淀完全的PH值
 |  |  |  | |
| 开始沉淀pH | 7.6 | 2.3 | 4.5 | 4.4 |
| 沉淀完全pH | 9.1 | 3.3 | 5.6 | 6.4 |
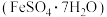 。(必选的试剂
。(必选的试剂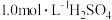 溶液、
溶液、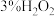 溶液、
溶液、 溶液、还原铁粉)
溶液、还原铁粉)
您最近半年使用:0次
2010·江苏盐城·一模
解题方法
9 . 以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:

(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是___ 。
(2)下列有关说法正确的是___________ 。
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是___________________________________ 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式___________ 。

(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是
(2)下列有关说法正确的是
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式
您最近半年使用:0次
13-14高三上·江苏泰州·期中
10 . 活性Fe3O4为黑色固体,有磁性,其不溶于水、碱和酒精、乙醚等有机溶剂中, Fe3O4在潮湿的空气中或高温下易被O2氧化。工业上利用锈蚀废铁为原料,利用共沉淀法制备活性Fe3O4(或写为FeO·Fe2O3)的流程如下:
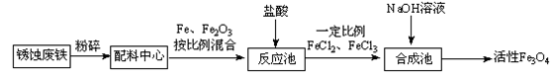
(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是_____________________ 。
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象_____________________________________________________________ 。
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于______ 。
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式______ 。(请写出计算过程)

(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式
您最近半年使用:0次



