名校
1 .  、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用 可合成多种化工产品。
可合成多种化工产品。
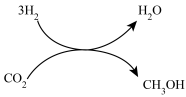
2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为___________ 。
②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为___________ 。过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇( )实现
)实现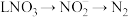 的转化,将
的转化,将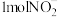 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为___________ 。
(3)硫酸生产及煤燃烧过程中产生的废气 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于___________ (填“电解质”或“非电解质”),氨水吸收少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
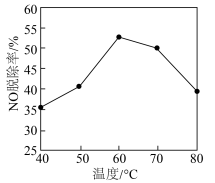
(4)氮的氧化物(NO、 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________ 。
 、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用
 可合成多种化工产品。
可合成多种化工产品。2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现
 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为 )实现
)实现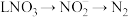 的转化,将
的转化,将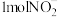 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为(3)硫酸生产及煤燃烧过程中产生的废气
 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于 ,反应的离子方程式为
,反应的离子方程式为(4)氮的氧化物(NO、
 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
您最近一年使用:0次
名校
解题方法
2 . 氯化亚铜是一种应用较广的催化剂,易水解,微溶于水,不溶于乙醇。以低品位铜矿砂(主要成分 )为原料制备氯化亚铜的路线如下:
)为原料制备氯化亚铜的路线如下:
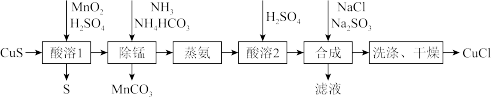
(1)“酸溶1”步骤中发生反应的化学方程式为_______ 。
(2)“除锰”步骤中 转化为
转化为 沉淀,
沉淀, 转变为
转变为 留在溶液中。则“除锰”步骤中发生反应的离子方程式为
留在溶液中。则“除锰”步骤中发生反应的离子方程式为_______ 。
(3)“合成”步骤加入 的速率不宜过快,否则会产生
的速率不宜过快,否则会产生_______ 气体(写化学式),除可能与酸溶时硫酸过量有关,还可能的原因是_______ 。(用离子方程式表示)
(4)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇洗涤除可洗去杂质,减少 的溶解外,还可以
的溶解外,还可以_______ 。
 )为原料制备氯化亚铜的路线如下:
)为原料制备氯化亚铜的路线如下: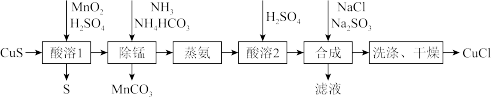
(1)“酸溶1”步骤中发生反应的化学方程式为
(2)“除锰”步骤中
 转化为
转化为 沉淀,
沉淀, 转变为
转变为 留在溶液中。则“除锰”步骤中发生反应的离子方程式为
留在溶液中。则“除锰”步骤中发生反应的离子方程式为(3)“合成”步骤加入
 的速率不宜过快,否则会产生
的速率不宜过快,否则会产生(4)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇洗涤除可洗去杂质,减少
 的溶解外,还可以
的溶解外,还可以
您最近一年使用:0次
2021-04-17更新
|
285次组卷
|
2卷引用:江苏省天一中学2020-2021学年高一下学期期中考试(强化班)化学试题
3 . 2021年9月28日,国务院新闻办公室发表《中国的全面小康》白皮书,宣布中国全面进入小康社会。化学学科正以独特学科价值为全面小康社会保驾护航。
I.屠呦呦制备青蒿素是高效的抗疟药。青蒿素为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点为35℃,乙醚浸取法是从青蒿中提取青蒿素的方法。其主要工艺如图所示:
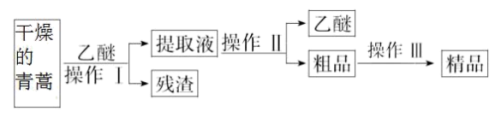
(1)乙醚浸取青蒿时,为增大青蒿素的浸出率,可采取的措施是___________ 。
(2)操作I需要的玻璃仪器主要有烧杯、玻璃棒、_____ ,操作II的名称是_______ 。
(3)操作III的主要过程可能是___________ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
II.我国正努力争取2060年前实现碳中和,用化学手段实现碳中和主要是对 进行捕获收集和资源化利用。
进行捕获收集和资源化利用。
(4)利用低浓度氨水吸收烟气中 生成
生成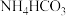 ,其离子方程式为
,其离子方程式为___________ 。
(5)下列说法有利于实现碳中和的是___________ 。
A.积极鼓励植树造林,降低空气中 含量
含量
B.研发利用二氧化碳合成淀粉的人工路线,实现 的资源化利用
的资源化利用
C.开发可燃冰(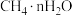 )作为新的替代能源
)作为新的替代能源
I.屠呦呦制备青蒿素是高效的抗疟药。青蒿素为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点为35℃,乙醚浸取法是从青蒿中提取青蒿素的方法。其主要工艺如图所示:

(1)乙醚浸取青蒿时,为增大青蒿素的浸出率,可采取的措施是
(2)操作I需要的玻璃仪器主要有烧杯、玻璃棒、
(3)操作III的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
II.我国正努力争取2060年前实现碳中和,用化学手段实现碳中和主要是对
 进行捕获收集和资源化利用。
进行捕获收集和资源化利用。(4)利用低浓度氨水吸收烟气中
 生成
生成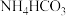 ,其离子方程式为
,其离子方程式为(5)下列说法有利于实现碳中和的是
A.积极鼓励植树造林,降低空气中
 含量
含量B.研发利用二氧化碳合成淀粉的人工路线,实现
 的资源化利用
的资源化利用C.开发可燃冰(
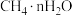 )作为新的替代能源
)作为新的替代能源
您最近一年使用:0次
名校
4 .  、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用 可合成多种化工产品。
可合成多种化工产品。
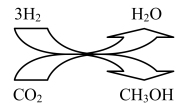
① 与
与 能在催化剂表面反应生成优质气体燃料
能在催化剂表面反应生成优质气体燃料 和
和 ,该反应的化学方程式为
,该反应的化学方程式为__ 。
②2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于___________ (填“电解质”或“非电解质”),标准状况下,1体积水约能溶解 体积
体积 ,所得氨水密度为
,所得氨水密度为 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为___________ 。
②氨水吸收少量 ,可生成
,可生成 ,反应的离子方程式为
,反应的离子方程式为___________ 。所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为___________ 。
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。
可合成多种化工产品。
①
 与
与 能在催化剂表面反应生成优质气体燃料
能在催化剂表面反应生成优质气体燃料 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于 体积
体积 ,所得氨水密度为
,所得氨水密度为 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为②氨水吸收少量
 ,可生成
,可生成 ,反应的离子方程式为
,反应的离子方程式为 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4和NH4HCO3的NaCl,某学生设计了如图所示方案以提取得到纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)。

a.150℃时,一定量的NH4HCO3完全分解后所得气体的摩尔质量为___________ (保留至小数点后一位)。
b.操作③所得的悬浊液与胶体的本质区别是___________ 。
c.进行操作②后,判断SO 是否已除尽操作是
是否已除尽操作是___________ 。
(2)高锰酸钾在酸性介质中的强氧化性广泛应用于分析化学中配平该反应方程式___________ 。
 KMnO4+
KMnO4+ H2C2O4+
H2C2O4+ H2SO4=
H2SO4= K2SO4+
K2SO4+ MnSO4+
MnSO4+ CO2↑+
CO2↑+ H2O(未配平)。
H2O(未配平)。
(3)用电弧法合成碳纳米管,常伴有大量杂质碳纳米颗粒,实验室中通常采用氧化气化法提纯,其化学反应方程式为:2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑。
①用双线桥法表示出电子的转移情况___________ 。
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑
②此反应的氧化产物和还原产物的物质的量之比为___________ 。
③要使10mL1.0mol•L-1K2Cr2O7溶液全部被还原,则至少要加入___________ mL2.0mol•L-1的H2SO4溶液,消耗C的质量为___________ g。
④若产生6.72CO2(标准状况下)气体,该反应转移的电子的物质的量为___________ 。
⑤H2SO4在上述反应中表现出来的性质是___________ (填字母)。
A.酸性 B.氧化性 C.还原性 D.吸水性
(1)实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4和NH4HCO3的NaCl,某学生设计了如图所示方案以提取得到纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)。

a.150℃时,一定量的NH4HCO3完全分解后所得气体的摩尔质量为
b.操作③所得的悬浊液与胶体的本质区别是
c.进行操作②后,判断SO
 是否已除尽操作是
是否已除尽操作是(2)高锰酸钾在酸性介质中的强氧化性广泛应用于分析化学中配平该反应方程式
 KMnO4+
KMnO4+ H2C2O4+
H2C2O4+ H2SO4=
H2SO4= K2SO4+
K2SO4+ MnSO4+
MnSO4+ CO2↑+
CO2↑+ H2O(未配平)。
H2O(未配平)。(3)用电弧法合成碳纳米管,常伴有大量杂质碳纳米颗粒,实验室中通常采用氧化气化法提纯,其化学反应方程式为:2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑。
①用双线桥法表示出电子的转移情况
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑
②此反应的氧化产物和还原产物的物质的量之比为
③要使10mL1.0mol•L-1K2Cr2O7溶液全部被还原,则至少要加入
④若产生6.72CO2(标准状况下)气体,该反应转移的电子的物质的量为
⑤H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.还原性 D.吸水性
您最近一年使用:0次
名校
解题方法
6 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温、常压下合成。
(1)甲组的同学欲制备原料气NO和 ,制备装置如图所示:
,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:

①为了使气体充分反应,从A处进入的气体是_______ (填“ ”或“NO”)。
”或“NO”)。
②装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、 外,另一个作用是
外,另一个作用是_______ 。
④装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为_______ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混合酸,一定条件下混合酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______ 。
(1)甲组的同学欲制备原料气NO和
 ,制备装置如图所示:
,制备装置如图所示:
为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
制备纯净 |  | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |
 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:
①为了使气体充分反应,从A处进入的气体是
 ”或“NO”)。
”或“NO”)。②装置连接顺序为a→
③装置Ⅲ、Ⅳ除可干燥NO、
 外,另一个作用是
外,另一个作用是④装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混合酸,一定条件下混合酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 完成下列有关物质的量的相关计算
(1)___________ 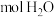 中含有的氧原子数与
中含有的氧原子数与 中含有的氧原子数相等。
中含有的氧原子数相等。
(2)等质量的 和
和 ,分子个数比为
,分子个数比为___________ ;等物质的量的 和
和 ,质子数之比为
,质子数之比为___________ ;含原子数目相等的 和
和 ,在相同条件下的体积比
,在相同条件下的体积比___________ 。
(3)臭氧是地球生命的保护伞。实验室可将氧气通过高压放电管来制取臭氧: 。
。
①若在上述反应中有30%的氧气转化为臭氧,所得混合气体的平均摩尔质量为___________ (保留一位小数)。
②将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为___________ L。
③实验室将氧气和臭氧的混合气体896mL (标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气态全部参加反应),粉末质量变为21.6g,则原混合气体中臭氧的体积分数为___________ 。
(4)我国自主研制成功的第一台低温超导除铁器,2008年11月2日在北京通过了技术鉴定。以Y2O3、BaCO3和CuO为原料,经研磨烧结可结合成一种超导物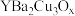 。欲合成0.5 mol此超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是
。欲合成0.5 mol此超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是___________ 、___________ 、___________ 。
(1)
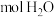 中含有的氧原子数与
中含有的氧原子数与 中含有的氧原子数相等。
中含有的氧原子数相等。(2)等质量的
 和
和 ,分子个数比为
,分子个数比为 和
和 ,质子数之比为
,质子数之比为 和
和 ,在相同条件下的体积比
,在相同条件下的体积比(3)臭氧是地球生命的保护伞。实验室可将氧气通过高压放电管来制取臭氧:
 。
。①若在上述反应中有30%的氧气转化为臭氧,所得混合气体的平均摩尔质量为
②将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为
③实验室将氧气和臭氧的混合气体896mL (标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气态全部参加反应),粉末质量变为21.6g,则原混合气体中臭氧的体积分数为
(4)我国自主研制成功的第一台低温超导除铁器,2008年11月2日在北京通过了技术鉴定。以Y2O3、BaCO3和CuO为原料,经研磨烧结可结合成一种超导物
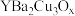 。欲合成0.5 mol此超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是
。欲合成0.5 mol此超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是
您最近一年使用:0次
8 . 甲烷是重要的能源和化工原料,可用于合成氨原料气的制备。
(1)已知1.0 g CH4完全燃烧生成液态水放出55.65 kJ的热量,则CH4燃烧的热化学方程式为___ 。
(2)CH4也可作为第三代固体氧化物燃料电池(SOFC)的燃料,电池结构如图所示。写出该电池负极电极反应式___ 。

(3)H2是合成NH3的原料气。
传统工业用煤炭制H2,原理为:
C+H2O CO+H2,CO+H2O
CO+H2,CO+H2O CO2+H2
CO2+H2
现代工业用CH4制H2,原理为:
CH4+H2O CO+3H2,CO+H2O
CO+3H2,CO+H2O CO2+H2
CO2+H2
与传统工业相比,现代工业制H2的优点有___ 。
(4)制得NH3可应用于制碱。我国化学家侯德邦发明的联合制碱法的主要过程如图所示(部分物质已略去)。

①操作I、II、III中涉及过滤的操作有___ (填操作序号)。
②将NH3和CO2通入饱和食盐水发生反应的化学方程式为___ 。
③针对上述过程,下列说法中正确的是___ (填字母)。
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、 、Cl-
、Cl-
(1)已知1.0 g CH4完全燃烧生成液态水放出55.65 kJ的热量,则CH4燃烧的热化学方程式为
(2)CH4也可作为第三代固体氧化物燃料电池(SOFC)的燃料,电池结构如图所示。写出该电池负极电极反应式

(3)H2是合成NH3的原料气。
传统工业用煤炭制H2,原理为:
C+H2O
 CO+H2,CO+H2O
CO+H2,CO+H2O CO2+H2
CO2+H2现代工业用CH4制H2,原理为:
CH4+H2O
 CO+3H2,CO+H2O
CO+3H2,CO+H2O CO2+H2
CO2+H2与传统工业相比,现代工业制H2的优点有
(4)制得NH3可应用于制碱。我国化学家侯德邦发明的联合制碱法的主要过程如图所示(部分物质已略去)。

①操作I、II、III中涉及过滤的操作有
②将NH3和CO2通入饱和食盐水发生反应的化学方程式为
③针对上述过程,下列说法中正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、
 、Cl-
、Cl-
您最近一年使用:0次
名校
9 . 硫及其化合物应用广泛,同时也会对环境造成污染。
(1)硫被用来制造黑色火药、火柴等,也是生产橡胶制品的重要原料。有一种硫单质Sx,该单质蒸气对氢气的相对密度为128,则x=___________ 。
(2)H2S有剧毒,可用作有机合成还原剂、农药、医药、催化剂的再生等。一种脱硫技术如下:第一步,用Na2CO3溶液吸收H2S:H2S+Na2CO3=NaHS+NaHCO3;第二步,用NaVO3溶液与NaHS反应生成硫单质,同时还产生Na2V4O9.Na2V4O9中V的平均化合价为___________ ,第二步反应的离子方程式为___________ 。
(3)SO2尾气先用氨水吸收生成(NH4)2SO3, 再被氧化成
再被氧化成 ,最终得到副产物氮肥,变废为宝。两种氧化方案如下:
,最终得到副产物氮肥,变废为宝。两种氧化方案如下:
方案l:2 +O2=2
+O2=2 。
。
方案2:2[Co(NH3)6]2++O2=[(NH3)5Co-O-O-Co(NH3)5]4++2NH3, +H2O+2NH3+[(NH3)5Co-O-O-Co(NH3)5]4+⇌
+H2O+2NH3+[(NH3)5Co-O-O-Co(NH3)5]4+⇌ +2[Co(NH3)6]3++2OH-。
+2[Co(NH3)6]3++2OH-。
①氨水中存在的分子有___________ (填化学式)。
②通过实验可知,[(NH3)5Co-O-O-Co(NH3)5]4+将 氧化为
氧化为 的能力大于O2,可能的原因是
的能力大于O2,可能的原因是___________ 。
(4)连二亚硫酸钠(Na2S2O4)适合作木浆造纸的漂白剂。实验室制法:将甲酸和溶于甲醇和水混合溶剂的NaOH混合反应后,再通入SO2气体即可制得连二亚硫酸钠,同时生成能使澄清石灰水变浑浊的气体,则该制备反应的化学方程式为___________ 。
(1)硫被用来制造黑色火药、火柴等,也是生产橡胶制品的重要原料。有一种硫单质Sx,该单质蒸气对氢气的相对密度为128,则x=
(2)H2S有剧毒,可用作有机合成还原剂、农药、医药、催化剂的再生等。一种脱硫技术如下:第一步,用Na2CO3溶液吸收H2S:H2S+Na2CO3=NaHS+NaHCO3;第二步,用NaVO3溶液与NaHS反应生成硫单质,同时还产生Na2V4O9.Na2V4O9中V的平均化合价为
(3)SO2尾气先用氨水吸收生成(NH4)2SO3,
 再被氧化成
再被氧化成 ,最终得到副产物氮肥,变废为宝。两种氧化方案如下:
,最终得到副产物氮肥,变废为宝。两种氧化方案如下:方案l:2
 +O2=2
+O2=2 。
。方案2:2[Co(NH3)6]2++O2=[(NH3)5Co-O-O-Co(NH3)5]4++2NH3,
 +H2O+2NH3+[(NH3)5Co-O-O-Co(NH3)5]4+⇌
+H2O+2NH3+[(NH3)5Co-O-O-Co(NH3)5]4+⇌ +2[Co(NH3)6]3++2OH-。
+2[Co(NH3)6]3++2OH-。①氨水中存在的分子有
②通过实验可知,[(NH3)5Co-O-O-Co(NH3)5]4+将
 氧化为
氧化为 的能力大于O2,可能的原因是
的能力大于O2,可能的原因是(4)连二亚硫酸钠(Na2S2O4)适合作木浆造纸的漂白剂。实验室制法:将甲酸和溶于甲醇和水混合溶剂的NaOH混合反应后,再通入SO2气体即可制得连二亚硫酸钠,同时生成能使澄清石灰水变浑浊的气体,则该制备反应的化学方程式为
您最近一年使用:0次
2021-10-13更新
|
695次组卷
|
3卷引用:江苏省苏州实验中学2021-2022学年第高一上学期12月月考调研化学试题
名校
10 . 中国科学院科研团队研究表明,在常温常压和可见光下,基于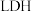 (一种固体催化剂)合成
(一种固体催化剂)合成 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:

(1)从能量转换的角度,该过程将______ 转化成为__________ ;
(2)该反应的化学方程式为:________________ ,氧化剂与还原剂的物质的量之比为__________ ;
(3)关于该反应的说法,正确的是_______
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于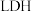 合成
合成 的过程属于人工固氮
的过程属于人工固氮
(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入_________ 至饱和,再通入足量的_________ 可制得 。
。
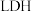 (一种固体催化剂)合成
(一种固体催化剂)合成 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:
(1)从能量转换的角度,该过程将
(2)该反应的化学方程式为:
(3)关于该反应的说法,正确的是
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于
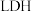 合成
合成 的过程属于人工固氮
的过程属于人工固氮(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入
 。
。
您最近一年使用:0次



