名校
解题方法
1 . 硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。请根据下图中的合成路线回答下列问题:
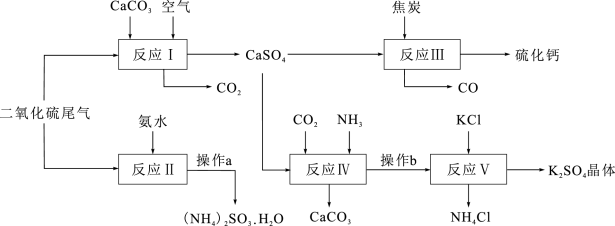
(1)生产中,常向反应II的溶液中加入强还原性的对苯二酚等物质,目的是__________ 。
(2)操作a中,必须的操作步骤有_______________ 、___________ 、过滤等。
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________ 。
(4)写出反应Ⅳ的化学方程式__________________________________________________ ;操作b所得滤液中阳离子的检验方法是________________ 。
(5)该生产过程中可以循环使用的物质是_______________ 。
(6)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________________________ 。
(7)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏[M(CaSO4·2H2O)=172],且反应过程中96%的二氧化硫转化为石膏,则可生产石膏______ t。

(1)生产中,常向反应II的溶液中加入强还原性的对苯二酚等物质,目的是
(2)操作a中,必须的操作步骤有
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为
(4)写出反应Ⅳ的化学方程式
(5)该生产过程中可以循环使用的物质是
(6)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式
(7)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏[M(CaSO4·2H2O)=172],且反应过程中96%的二氧化硫转化为石膏,则可生产石膏
您最近一年使用:0次
2 . 回答下列问题:
(1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生___________ 反应,说明亚硝酸钠具有___________ 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有___________ 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=CeF3+16NH3↑+12H2O+N2↑,该反应中还原剂是___________ ,反应中被氧化的氮原子与未被氧化的氮原子个数比为___________ 。
(3)过氧化氢溶液可作为采矿业废液消毒剂,如消除废液中剧毒的氰化钾(KCN,其中氮元素为-3价),反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平)。
①该反应是否属于氧化还原反应?___________ (填“是”或“否”),理由是___________ 。若是,则被还原的元素是___________ 。
②生成物A的化学式是___________ 。
③该反应中发生氧化反应的物质是___________ ,理由是___________ 。
④若生成4个NH3分子,转移电子数为___________ 。
⑤用双线桥法表示反应中电子转移的方向和数目:___________ 。
(1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=CeF3+16NH3↑+12H2O+N2↑,该反应中还原剂是
(3)过氧化氢溶液可作为采矿业废液消毒剂,如消除废液中剧毒的氰化钾(KCN,其中氮元素为-3价),反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平)。
①该反应是否属于氧化还原反应?
②生成物A的化学式是
③该反应中发生氧化反应的物质是
④若生成4个NH3分子,转移电子数为
⑤用双线桥法表示反应中电子转移的方向和数目:
您最近一年使用:0次
名校
解题方法
3 . 氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生产氮肥的原料。氮及其部分化合物的转化关系如图所示,回答下列问题:
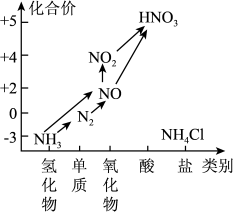
(1)下列反应中,不属于氮的固定的是_______
(2)氨的电子式是_______ 。
(3)在物质转化图中的各气体,可用排水法收集的气体是_______ (填化学式,下同),既可以用浓硫酸干燥,又可以用碱石灰干燥的是气体是_______ 。
(4)实验室常用NH4Cl与Ca(OH)2制取氨气,请写出该反应的化学方程式_______ 。而工业上则由氮气和氢气直接合成氨,该反应的化学方程式为_______ 。
(5)NO、CO都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过,反应转化为无污染的空气成分,则反应的化学方程式是_______ 。
(6)氮的一种化合物肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量是_______ kJ。


(1)下列反应中,不属于氮的固定的是_______
| A.N2和H2在一定条件下合成NH3 |
| B.豆科植物把空气中的氮气转化为化合态的氮 |
| C.雷电时,空气中的N2与O2反应生成NO |
| D.由NH3制碳酸氢铵 |
(3)在物质转化图中的各气体,可用排水法收集的气体是
(4)实验室常用NH4Cl与Ca(OH)2制取氨气,请写出该反应的化学方程式
(5)NO、CO都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过,反应转化为无污染的空气成分,则反应的化学方程式是
(6)氮的一种化合物肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量是

您最近一年使用:0次



