名校
解题方法
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:
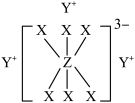
回答下列问题:
(1)请写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是_______ 。
a. Ga位于元素周期表第四周期IVA族
b. GaN为新型无机非金属材料
c. Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d. 酸性:H3AsO4>H3PO4>HNO3
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示

利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。
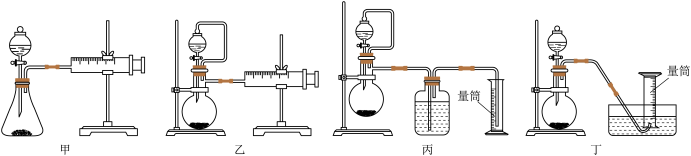
从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品ag,若实验测得氢气的体积为V L(标准状态),则YZM4样品纯度为_______ (用代数式表示)。

回答下列问题:
(1)请写出YM的电子式:
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列有关说法正确的是
a. Ga位于元素周期表第四周期IVA族
b. GaN为新型无机非金属材料
c. Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d. 酸性:H3AsO4>H3PO4>HNO3
(5)YZM4是有机合成的重要还原剂,其合成路线如图所示

利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为
②现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为V L(标准状态),则YZM4样品纯度为
您最近一年使用:0次
名校
解题方法
2 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
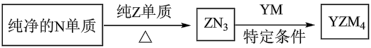
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
3 . 四氯化锡 常用作分析试剂、有机合成脱水剂等。设计如下装置制备
常用作分析试剂、有机合成脱水剂等。设计如下装置制备 。
。

已知:① 在常温下为无色液体,熔点
在常温下为无色液体,熔点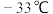 ,沸点
,沸点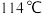 ,在空气中易与水蒸气反应;
,在空气中易与水蒸气反应;
②装置D中发生反应: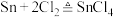 。
。
回答下列问题:
(1)装置A中反应的化学方程式为______ ,若反应中消耗1个 ,则消耗
,则消耗______ 个表现出还原性的 。
。
(2)实验前,应进行的操作是______ ,实验开始时,应先点燃处______ (填“A”或“D”)的酒精灯。
(3)装置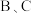 所盛装的试剂分别是
所盛装的试剂分别是______ 、______ (填字母),装置 的作用是
的作用是______ 。
a.饱和食盐水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.碱石灰 e.无水硫酸铜 f.无水氯化钙
(4)装置 中使用冰水浴的目的是
中使用冰水浴的目的是______ 。
(5)若装置 中的反应在加热条件下进行,则会生成
中的反应在加热条件下进行,则会生成 和
和 ,发生反应的离子方程式为
,发生反应的离子方程式为______ 。
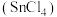 常用作分析试剂、有机合成脱水剂等。设计如下装置制备
常用作分析试剂、有机合成脱水剂等。设计如下装置制备 。
。
已知:①
 在常温下为无色液体,熔点
在常温下为无色液体,熔点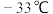 ,沸点
,沸点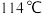 ,在空气中易与水蒸气反应;
,在空气中易与水蒸气反应;②装置D中发生反应:
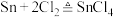 。
。回答下列问题:
(1)装置A中反应的化学方程式为
 ,则消耗
,则消耗 。
。(2)实验前,应进行的操作是
(3)装置
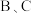 所盛装的试剂分别是
所盛装的试剂分别是 的作用是
的作用是a.饱和食盐水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.碱石灰 e.无水硫酸铜 f.无水氯化钙
(4)装置
 中使用冰水浴的目的是
中使用冰水浴的目的是(5)若装置
 中的反应在加热条件下进行,则会生成
中的反应在加热条件下进行,则会生成 和
和 ,发生反应的离子方程式为
,发生反应的离子方程式为
您最近一年使用:0次
2023-12-26更新
|
180次组卷
|
2卷引用:江西省鹰潭市2023-2024学年高一上学期11月期中化学试题
名校
解题方法
4 . 三氯化六氨合钴(Ⅲ) 是钴化合物合成中的重要原料,实验室以
是钴化合物合成中的重要原料,实验室以 为原料制备
为原料制备 。其中
。其中 可以通过钴和纯净氯气反应制得,实验室制备
可以通过钴和纯净氯气反应制得,实验室制备 可用下图实验装置实现。
可用下图实验装置实现。
已知:①钴单质在 以上易被氧气氧化,
以上易被氧气氧化, 易潮解
易潮解

(1)写出A装置的化学方程式___________
(2)反应开始前应先打开A中盛放浓盐酸仪器的活塞,再点燃D中酒精灯,其目的是___________ 。
(3)新制氯水中,含有氯元素的微粒有___________ (填微粒符号)。
(4)把氯气溶于水得到新制氯水,把该氯水加入滴有酚酞的 溶液中,发现溶液红色褪去。为探究褪色的原因,有同学提出三种猜想:
溶液中,发现溶液红色褪去。为探究褪色的原因,有同学提出三种猜想:
猜想1:氯水消耗了 ;
;
猜想2:氯水消耗了酚酞;
猜想3:氯水同时消耗了 和酚酞。
和酚酞。
为验证上述猜想,该同学取上述褪色后的溶液于甲、乙两只试管中。向甲试管中滴加足量 溶液,向乙试管中滴加足量酚酞溶液,如果观察到
溶液,向乙试管中滴加足量酚酞溶液,如果观察到___________ (填实验现象),则猜想3成立。
(5)该同学为了完成上述实验探究,在实验室配制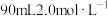 氢氧化钠溶液。
氢氧化钠溶液。
①配置该溶液需要称量氢氧化钠固体的质量是___________ g。
②关于配制过程的说法正确的是___________ (填字母)。
A.将称好的固体直接在容量瓶中加水溶解
B.将溶解后的溶液转移到容量瓶时,有少量的溶液溅出,会使所配溶液浓度偏低
C.容量瓶不干燥,含有少量蒸馏水,会使所配溶液浓度偏低
D.溶液未冷却到室温就移入容量瓶定容,会使所配溶液浓度偏高
 是钴化合物合成中的重要原料,实验室以
是钴化合物合成中的重要原料,实验室以 为原料制备
为原料制备 。其中
。其中 可以通过钴和纯净氯气反应制得,实验室制备
可以通过钴和纯净氯气反应制得,实验室制备 可用下图实验装置实现。
可用下图实验装置实现。已知:①钴单质在
 以上易被氧气氧化,
以上易被氧气氧化, 易潮解
易潮解
(1)写出A装置的化学方程式
(2)反应开始前应先打开A中盛放浓盐酸仪器的活塞,再点燃D中酒精灯,其目的是
(3)新制氯水中,含有氯元素的微粒有
(4)把氯气溶于水得到新制氯水,把该氯水加入滴有酚酞的
 溶液中,发现溶液红色褪去。为探究褪色的原因,有同学提出三种猜想:
溶液中,发现溶液红色褪去。为探究褪色的原因,有同学提出三种猜想:猜想1:氯水消耗了
 ;
; 猜想2:氯水消耗了酚酞;
猜想3:氯水同时消耗了
 和酚酞。
和酚酞。为验证上述猜想,该同学取上述褪色后的溶液于甲、乙两只试管中。向甲试管中滴加足量
 溶液,向乙试管中滴加足量酚酞溶液,如果观察到
溶液,向乙试管中滴加足量酚酞溶液,如果观察到(5)该同学为了完成上述实验探究,在实验室配制
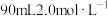 氢氧化钠溶液。
氢氧化钠溶液。①配置该溶液需要称量氢氧化钠固体的质量是
②关于配制过程的说法正确的是
A.将称好的固体直接在容量瓶中加水溶解
B.将溶解后的溶液转移到容量瓶时,有少量的溶液溅出,会使所配溶液浓度偏低
C.容量瓶不干燥,含有少量蒸馏水,会使所配溶液浓度偏低
D.溶液未冷却到室温就移入容量瓶定容,会使所配溶液浓度偏高
您最近一年使用:0次
名校
5 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
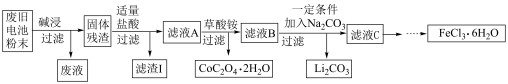
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
257次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高一上学期1月月考化学试题
名校
6 . 亚硝酰氯( ,沸点:
,沸点: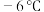 ;易水解,能与
;易水解,能与 反应)可作为有机合成试剂。在实验室可用
反应)可作为有机合成试剂。在实验室可用 (沸点:
(沸点: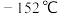 )和
)和 (沸点:
(沸点: )在一定条件下反应制备,其反应原理为
)在一定条件下反应制备,其反应原理为 。回答下列问题:
。回答下列问题:
(1)实验室常用铜与稀硝酸反应制备 ,若将
,若将 加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则
加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则 物质的量浓度为
物质的量浓度为_______ 。
(2)实验室若以 和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的
和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的 ,则其连接顺序为
,则其连接顺序为_______ →jh(按气流方向,用小写字母表示)。

(3) 的制备,装置(夹持仪器已省略)如下图所示。
的制备,装置(夹持仪器已省略)如下图所示。
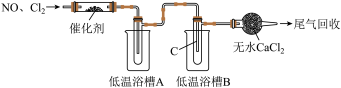
①将催化剂负载在玻璃棉上的目的是_______ 。
②为分离产物和未反应的原料,低温浴槽A的温度区间应控制在_______ (填字母)。
A.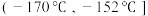 B.
B.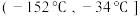 C.
C.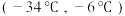
③仪器C中收集的物质是_______ (填化学式)。
(4) 样品中
样品中 的质量分数测定。取
的质量分数测定。取
 样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用
样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用 的
的 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。 的质量分数为
的质量分数为_______ 。
 ,沸点:
,沸点: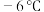 ;易水解,能与
;易水解,能与 反应)可作为有机合成试剂。在实验室可用
反应)可作为有机合成试剂。在实验室可用 (沸点:
(沸点: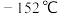 )和
)和 (沸点:
(沸点: )在一定条件下反应制备,其反应原理为
)在一定条件下反应制备,其反应原理为 。回答下列问题:
。回答下列问题:(1)实验室常用铜与稀硝酸反应制备
 ,若将
,若将 加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则
加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则 物质的量浓度为
物质的量浓度为(2)实验室若以
 和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的
和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的 ,则其连接顺序为
,则其连接顺序为
(3)
 的制备,装置(夹持仪器已省略)如下图所示。
的制备,装置(夹持仪器已省略)如下图所示。
①将催化剂负载在玻璃棉上的目的是
②为分离产物和未反应的原料,低温浴槽A的温度区间应控制在
A.
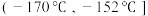 B.
B.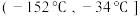 C.
C.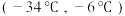
③仪器C中收集的物质是
(4)
 样品中
样品中 的质量分数测定。取
的质量分数测定。取
 样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用
样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用 的
的 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。 的质量分数为
的质量分数为
您最近一年使用:0次
名校
7 . 亚氯酸钠( )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用子各种纤维和某些食品的漂白,过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用子各种纤维和某些食品的漂白,过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示:
① 的熔点为
的熔点为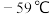 、沸点为
、沸点为 极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、
极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。
②
(1)A中盛放 的仪器名称为
的仪器名称为_________ ;按图组装好仪器后,首先应该进行的操作是_________ .
(2)装置 的作用是
的作用是_________ ; 装置使用冰水浴的目的
装置使用冰水浴的目的_________ (写序号)。
①减少 的分解 ②增大
的分解 ②增大 的溶解度 ③减少
的溶解度 ③减少 的分解
的分解
(3) 是合成
是合成 的重要原料,写出三颈烧瓶中由
的重要原料,写出三颈烧瓶中由 生成
生成 的化学方程式:
的化学方程式:__________________ .
(4)装置 中加入
中加入 溶液的目的除了作反应物外,还可以
溶液的目的除了作反应物外,还可以__________________ ;空气的流速过慢或过快都会影响 的产率,试分析空气流速过慢影响
的产率,试分析空气流速过慢影响 产率的原因:
产率的原因:__________________ .
(5)该套装置存在的明显缺陷是__________________ .
(6)若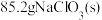 最终制得纯净的
最终制得纯净的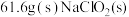 ,则
,则 的产率是
的产率是_________ (保留两位有效数字)。
 )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用子各种纤维和某些食品的漂白,过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用子各种纤维和某些食品的漂白,过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示: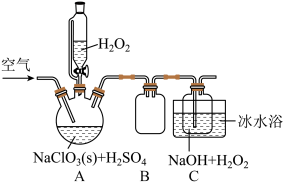
①
 的熔点为
的熔点为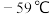 、沸点为
、沸点为 极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、
极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。②

(1)A中盛放
 的仪器名称为
的仪器名称为(2)装置
 的作用是
的作用是 装置使用冰水浴的目的
装置使用冰水浴的目的①减少
 的分解 ②增大
的分解 ②增大 的溶解度 ③减少
的溶解度 ③减少 的分解
的分解(3)
 是合成
是合成 的重要原料,写出三颈烧瓶中由
的重要原料,写出三颈烧瓶中由 生成
生成 的化学方程式:
的化学方程式:(4)装置
 中加入
中加入 溶液的目的除了作反应物外,还可以
溶液的目的除了作反应物外,还可以 的产率,试分析空气流速过慢影响
的产率,试分析空气流速过慢影响 产率的原因:
产率的原因:(5)该套装置存在的明显缺陷是
(6)若
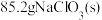 最终制得纯净的
最终制得纯净的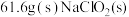 ,则
,则 的产率是
的产率是
您最近一年使用:0次
2023-12-04更新
|
141次组卷
|
4卷引用:江西省上饶市婺源天佑中学2023-2024学年高一上学期12月考试化学试题
18-19高一下·江西南昌·阶段练习
解题方法
8 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

①为制备纯净干燥的气体,装置II中盛放的药品是:__________________ 。写出该装置制备氯气的离子方程式:______________________________________ 。
②为了制备纯净干燥的NO,装置I中蒸馏烧瓶中的试剂为Cu,分液漏斗中装有稀硝酸,则装置II中盛放的是__________ 。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→_________________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO和Cl2外,另一个作用是________________________________ 。
③装置Ⅶ的作用是______________________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________________________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

①为制备纯净干燥的气体,装置II中盛放的药品是:
②为了制备纯净干燥的NO,装置I中蒸馏烧瓶中的试剂为Cu,分液漏斗中装有稀硝酸,则装置II中盛放的是
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO和Cl2外,另一个作用是
③装置Ⅶ的作用是
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
您最近一年使用:0次



