名校
解题方法
1 . 某实验小组以含铁污泥(主要成分为 、
、 、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。

根据所学知识,回答下列问题:
(1)路线Ⅰ中,加入 溶液发生的离子反应方程式是
溶液发生的离子反应方程式是__________ 。
(2)写出“酸浸”时, 与硫酸反应的化学方程式:
与硫酸反应的化学方程式:__________ ;检验含有 的方法是
的方法是__________ 。
(3)“滤液X”中一定含有的阳离子为__________ 。
(4)实验室中配制 溶液时通常需加入少量的试剂a,目的是
溶液时通常需加入少量的试剂a,目的是__________ ,请写出相应的离子方程式:__________ 。
 、
、 、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
根据所学知识,回答下列问题:
(1)路线Ⅰ中,加入
 溶液发生的离子反应方程式是
溶液发生的离子反应方程式是(2)写出“酸浸”时,
 与硫酸反应的化学方程式:
与硫酸反应的化学方程式: 的方法是
的方法是(3)“滤液X”中一定含有的阳离子为
(4)实验室中配制
 溶液时通常需加入少量的试剂a,目的是
溶液时通常需加入少量的试剂a,目的是
您最近一年使用:0次
2 . 莽草酸能够通过抑制血小板聚集、防止脑血栓的形成,下图是合成莽草酸的路线(部分反应条件和步骤已略去),回答下列问题。___________ ,该物质可发生加聚反应,其产物的结构简式为___________ 。
(2)物质D中含氧官能团的名称为___________ 。
(3)莽草酸的化学式为___________ ,莽草酸与足量NaOH溶液反应的化学方程式为___________ 。
(4)一定条件下莽草酸与酸R可生成酯(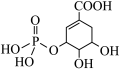 ),根据酯化反应原理可知酸R为
),根据酯化反应原理可知酸R为___________ (写化学式)。
(5)A与 发生加成反应的产物M与G互为同系物,G的相对分子质量比M大28.则符合条件的G有
发生加成反应的产物M与G互为同系物,G的相对分子质量比M大28.则符合条件的G有___________ 种。

已知:在有机化学中也可用键线式表示有机物的结构,如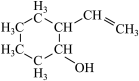 可简写为
可简写为
(2)物质D中含氧官能团的名称为
(3)莽草酸的化学式为
(4)一定条件下莽草酸与酸R可生成酯(
 ),根据酯化反应原理可知酸R为
),根据酯化反应原理可知酸R为(5)A与
 发生加成反应的产物M与G互为同系物,G的相对分子质量比M大28.则符合条件的G有
发生加成反应的产物M与G互为同系物,G的相对分子质量比M大28.则符合条件的G有
您最近一年使用:0次
解题方法
3 . 铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,“绿锈”俗称“铜绿”【化学式为Cu2(OH)2CO3】,“铜绿”能跟酸反应生成铜盐和CO2,H2O,某同学利用下述系列反应实现了“铜→铜绿→…→铜”的转化:

回答下列问题:
(1)上述转化过程中,属于化合反应的有___________ (填序号,下同),属于分解反应的有___________ ,属于氧化还原反应的有___________ 。
(2)“铜绿”与盐酸反应的离子方程式为___________ 。
(3)现有Cu、CuO、CuCl2、CuSO4四种物质,其中能代替上述转化关系中A的是___________ ,B的化学式为___________ 。
(4)以Fe、CuO、H2SO4三种物质为原料,设计制取Cu的路线___________ (仿照上述流程,并在“→”上注明试剂和反应条件)

回答下列问题:
(1)上述转化过程中,属于化合反应的有
(2)“铜绿”与盐酸反应的离子方程式为
(3)现有Cu、CuO、CuCl2、CuSO4四种物质,其中能代替上述转化关系中A的是
(4)以Fe、CuO、H2SO4三种物质为原料,设计制取Cu的路线
您最近一年使用:0次
名校
解题方法
4 . 按要求回答下列问题
Ⅰ.化学科学在药物的开发、合成和使用中具有至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:___________ 。
(2)利用提供试剂设计实验证明补铁剂中只含亚铁盐(可选试剂:氯水、硫氰化钾、过氧化氢),取补铁剂少许溶于水配成溶液,___________ (填写实验操作、现象和结论)
(3)氢氧化亚铁在空气中极不稳定,易被空气中氧气氧化。这一过程中观察到的现象是___________ ,反应的化学方程式是___________ 。
Ⅱ.镁铝合金是建造航空母舰的主体材料。
(4)镁铝合金的硬度比金属铝的硬度___________ (选填:大、小)。使用该合金前用NaOH溶液处理Al2O3,其离子方程式为___________ 。取一定量的镁铝合金均分为两份,分别与足量的盐酸、NaOH溶液充分反应,产生气体的物质的量之比为5:3,合金中镁铝的物质的量之比为___________ 。
Ⅰ.化学科学在药物的开发、合成和使用中具有至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:
(2)利用提供试剂设计实验证明补铁剂中只含亚铁盐(可选试剂:氯水、硫氰化钾、过氧化氢),取补铁剂少许溶于水配成溶液,
(3)氢氧化亚铁在空气中极不稳定,易被空气中氧气氧化。这一过程中观察到的现象是
Ⅱ.镁铝合金是建造航空母舰的主体材料。
(4)镁铝合金的硬度比金属铝的硬度
您最近一年使用:0次
2024-01-08更新
|
54次组卷
|
2卷引用:河南省郑州市第七高级中学2023-2024学年高一上学期12月考试化学试题
解题方法
5 . Ⅰ.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
(1)Ca(ClO)2中Cl的化合价为___________ ,Ca(ClO)2具有较强的_________ (填“氧化”或“还原”)性,是常用的漂白粉的有效成分。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为 ,该反应的离子方程式为:
,该反应的离子方程式为:___________ 。
②NaClO可将酸性废水中的Fe2+氧化为Fe3+,本身被还原为NaCl,该反应过程中氧化剂与还原剂的物质的量之比为___________ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题(消石灰为氢氧化钙):
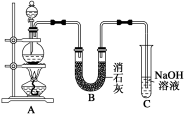
(3)在A装置中用固体二氧化锰与浓盐酸在加热条件下反应制取氯气,写出该反应的化学方程式:___ 。
(4)C装置的作用是(用离子方程式表示)_____________ 。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是将U型管置于________ 中(填“冰水浴还是热水浴”)。
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,装置的改进措施为______ 。
(1)Ca(ClO)2中Cl的化合价为
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为
 ,该反应的离子方程式为:
,该反应的离子方程式为:②NaClO可将酸性废水中的Fe2+氧化为Fe3+,本身被还原为NaCl,该反应过程中氧化剂与还原剂的物质的量之比为
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题(消石灰为氢氧化钙):

(3)在A装置中用固体二氧化锰与浓盐酸在加热条件下反应制取氯气,写出该反应的化学方程式:
(4)C装置的作用是(用离子方程式表示)
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是将U型管置于
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,装置的改进措施为
您最近一年使用:0次
名校
6 . 填空:
(1)有下列微粒或物质:①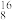 O、
O、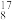 O、
O、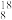 O②H2O、D2O③石墨、金刚石④H2、D2、T2⑤H、D、T⑥
O②H2O、D2O③石墨、金刚石④H2、D2、T2⑤H、D、T⑥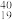 K、
K、 Ca、
Ca、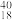 Ar,回答下列问题:
Ar,回答下列问题:
a.互为同位素的是_______ ;
b.互为同素异形体的是_______ ;
c.上述微粒中出现的核素符号有_______ 种;
d.由①和⑤中的微粒能结合成水,可得相对分子质量不同的水分子种数为_______ 种,相对分子质量最大的是_______ (写化学式)。
(2)相同质量的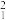 H2
H2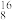 O与
O与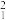 H2
H2 O所含中子数之比为
O所含中子数之比为_______ 。
(3)元素周期表中,甲、乙分别是第五周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n的关系为_______ 。
(4)某中学化学兴趣小组同学为探究元素周期律,设计了如下实验。利用下图所示装置可以验证元素的非金属性的变化规律。
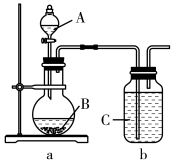
甲同学设计实验:A为硝酸,B为石灰石,C为硅酸钠溶液。实验现象:a装置中圆底烧瓶中产生大量气泡,b装置中出现浑浊或白色沉淀。
①甲同学由实验得出酸性由强到弱的顺序为:_______ 。
②乙同学分析甲同学设计的实验方案,认为该方案存在不足之处,请分析乙同学的理由_______ ,并提出改进实验方案_______ 。
(1)有下列微粒或物质:①
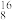 O、
O、 O、
O、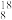 O②H2O、D2O③石墨、金刚石④H2、D2、T2⑤H、D、T⑥
O②H2O、D2O③石墨、金刚石④H2、D2、T2⑤H、D、T⑥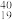 K、
K、 Ca、
Ca、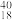 Ar,回答下列问题:
Ar,回答下列问题:a.互为同位素的是
b.互为同素异形体的是
c.上述微粒中出现的核素符号有
d.由①和⑤中的微粒能结合成水,可得相对分子质量不同的水分子种数为
(2)相同质量的
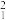 H2
H2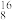 O与
O与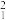 H2
H2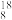 O所含中子数之比为
O所含中子数之比为(3)元素周期表中,甲、乙分别是第五周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n的关系为
(4)某中学化学兴趣小组同学为探究元素周期律,设计了如下实验。利用下图所示装置可以验证元素的非金属性的变化规律。

甲同学设计实验:A为硝酸,B为石灰石,C为硅酸钠溶液。实验现象:a装置中圆底烧瓶中产生大量气泡,b装置中出现浑浊或白色沉淀。
①甲同学由实验得出酸性由强到弱的顺序为:
②乙同学分析甲同学设计的实验方案,认为该方案存在不足之处,请分析乙同学的理由
您最近一年使用:0次
名校
解题方法
7 . 硫酸钙可用作建筑材料和水泥原料外,也可用作硫酸、漂白粉的生产原料。生产流程如图,下列说法正确的是
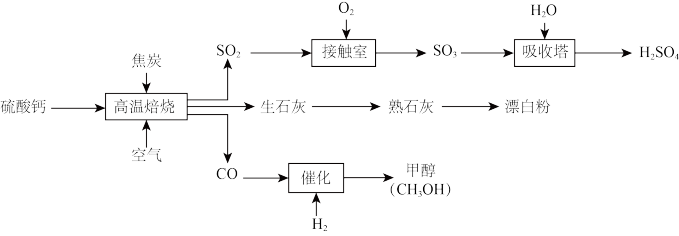

| A.“高温焙烧”时产生的气体均为酸性氧化物 |
| B.漂白粉是纯净物,其成分为Ca(ClO)2 |
| C.“接触室”与“吸收塔”内均发生了化合反应,硫的价态均升高 |
D.合成甲醇的化学反应为CO+2H2 CH3OH CH3OH |
您最近一年使用:0次
2022-11-11更新
|
119次组卷
|
3卷引用:河南省郑州市第四高级中学2023-2024学年高一上学期第二次月考 化学试题
名校
8 . 习总书记在2021年11月第26次《联合国气候变化框架公约》世界领导人大会上代表中国政府庄严承诺中国在2030年前碳达峰。下列说法正确的是
A.中科院天津化学研究所在世界上首次利用人工方法将 合成淀粉,可以实现利用空气“生产粮食” 合成淀粉,可以实现利用空气“生产粮食” |
| B.以煤为原料的火力发电厂发生的化学反应不包含还原反应 |
| C.天然气不充分燃烧的产物都是酸性氧化物 |
| D.推进煤炭消费替代和转型升级,大力发展新能源不是实现碳达峰的途径之一 |
您最近一年使用:0次
2022-01-25更新
|
350次组卷
|
4卷引用:河南省实验中学2023~2024学年高一上学期开学考试化学试题



