真题
名校
1 . 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
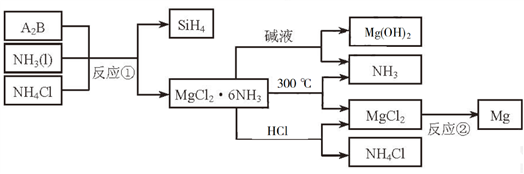
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________ ,Mg在元素周期表中的位置:_____________________ ,Mg(OH)2的电子式:____________________ 。
(2)A2B的化学式为_______________ 。反应②的必备条件是_______________ 。上图中可以循环使用的物质有_______________ 。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________ (写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________ 。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备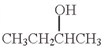 所需醛的可能结构简式:
所需醛的可能结构简式:_______________ 。

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):
(2)A2B的化学式为
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备
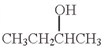 所需醛的可能结构简式:
所需醛的可能结构简式:
您最近一年使用:0次
2018-06-09更新
|
3024次组卷
|
13卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题
【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题云南省绿春县二中2019-2020学年高一上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用(已下线)高考母题题源15 物质结构与推断(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物云南省玉溪元江民中2020届高三开学考试化学试题云南省弥勒市第四中学2019-2020学年高二上学期开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记
名校
2 . 工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。
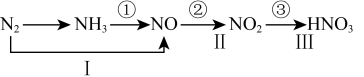
(1)写出N2的一种用途_____________________ 。
(2)工业合成NH3的化学方程式为______________________ 。
(3)写出工业制硝酸第③步反应化学方程式_____________________ 。
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:____________ 。该反应中发生氧化反应的物质是_______ ,1 mol氧化剂_________ (填“得到”或“失去”)_______ mol电子。
(ⅱ)64.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是( )
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+______ 
______ + ______ + N2O↑ + H2O
并配平其对应的离子方程式:__ Fe2++__ NO3-+__ H+ =__ Fe3++__ N2O↑+__ H2O

(1)写出N2的一种用途
(2)工业合成NH3的化学方程式为
(3)写出工业制硝酸第③步反应化学方程式
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:
(ⅱ)64.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+

并配平其对应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
575次组卷
|
2卷引用:【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高一下学期第一次月考(开学)化学试题
名校
解题方法
3 . 二氯化二硫( )在工业上用于橡胶的硫化。为在实验室合成
)在工业上用于橡胶的硫化。为在实验室合成 ,某化学研究学习小组查阅了相关资料,得到信息:
,某化学研究学习小组查阅了相关资料,得到信息:
①将干燥的氯气在110∼140°C与硫反应,即可得 粗品。
粗品。
②相关物质的部分性质如下表:
设计实验装置图如图所示:

(1)图中气体发生和尾气处理装置不够完善,请你提出改进意见:_____ 。
利用改进后的正确装置进行实验,请回答下列问题:
(2)D中的试剂是_____ 。
(3)仪器B的名称是_____ 。
(4)B中反应的离子方程式:_____ ,E中反应的化学方程式:_____ 。
(5)如果在加热E时温度过高,对实验结果的影响是_____ 。
(6) 粗品中可能混有的杂质是
粗品中可能混有的杂质是 、S,为了提高
、S,为了提高 的纯度,关键的操作是控制好温度和
的纯度,关键的操作是控制好温度和_____ 。
(7)装置H中盛有NaOH溶液,其作用是_____ ,发生反应的化学方程式为_____ 。
 )在工业上用于橡胶的硫化。为在实验室合成
)在工业上用于橡胶的硫化。为在实验室合成 ,某化学研究学习小组查阅了相关资料,得到信息:
,某化学研究学习小组查阅了相关资料,得到信息:①将干燥的氯气在110∼140°C与硫反应,即可得
 粗品。
粗品。②相关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | / |
 | -77 | 137 | 遇水生成HCl、 、S;300℃以上完全分解; 、S;300℃以上完全分解; |

(1)图中气体发生和尾气处理装置不够完善,请你提出改进意见:
利用改进后的正确装置进行实验,请回答下列问题:
(2)D中的试剂是
(3)仪器B的名称是
(4)B中反应的离子方程式:
(5)如果在加热E时温度过高,对实验结果的影响是
(6)
 粗品中可能混有的杂质是
粗品中可能混有的杂质是 、S,为了提高
、S,为了提高 的纯度,关键的操作是控制好温度和
的纯度,关键的操作是控制好温度和(7)装置H中盛有NaOH溶液,其作用是
您最近一年使用:0次
4 . 亚稍酰氯(NOCl,熔点为-64.5℃,沸点为-5.5℃)是一种红褐色液体或黄色气体,遇水反应生成一种氢化物和两种氧化物,可用于合成清洁剂、触媒剂及中间体等。某学习小组在实验室中用Cl2和NO制备NOCl,请回答下列问题:
(1)原料气NO和Cl2的制备。________ 。实验室制备NO的反应的离子方程式为____________ 。
②实验室制备Cl2,可选择图中的装置_______ (填标号);制备并收集干燥的Cl2的装置连接顺序:_________ (按气流方向,用小写字母表示)。
(2)利用制得的NO和Cl2制备亚硝酰氯(NOCl),装置如图所示。_______ ,在装置I、Ⅱ选择通入气体时,应该先通入_______ ,原因是____________ 。
②装置Ⅳ的作用是___________ ;若无装置Ⅴ,则装置Ⅳ中NOCl可能发生反应的化学方程式为_______________ 。
③查阅资料知,王水是浓硝酸与浓盐酸的混合酸,一定条件下该混合酸可自身反应生成亚硝酰氯、氯气和水,该反应的化学方程式为______________ 。
(3)装置Ⅵ中倒置漏斗的作用为______ ,装置Ⅵ中发生反应的离子方程式为__________ 。
(1)原料气NO和Cl2的制备。
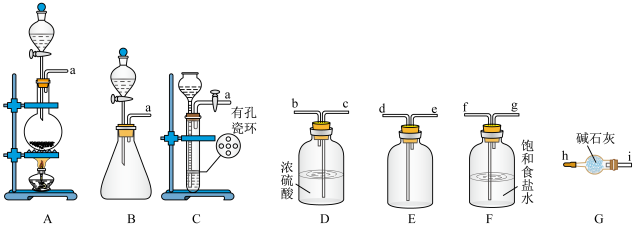
②实验室制备Cl2,可选择图中的装置
(2)利用制得的NO和Cl2制备亚硝酰氯(NOCl),装置如图所示。
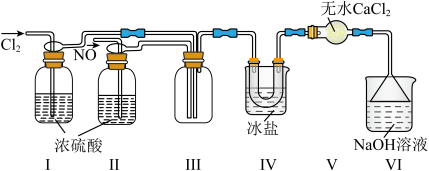
②装置Ⅳ的作用是
③查阅资料知,王水是浓硝酸与浓盐酸的混合酸,一定条件下该混合酸可自身反应生成亚硝酰氯、氯气和水,该反应的化学方程式为
(3)装置Ⅵ中倒置漏斗的作用为
您最近一年使用:0次
名校
解题方法
5 . 氨基钠(NaNH2)是合成维生素A的原料。工业上将金属钠于97~100℃熔融,向反应器中缓慢通入无水液氨(NH3),再加热至350~360℃生成氨基钠和氢气。下列说法中,不正确 的是
| A.钠可能与水反应 | B.钠的熔点比铁的熔点低 |
| C.维生素A中一定含有钠元素 | D.反应的化学方程式为:2Na+2NH3 2NaNH2+H2↑ 2NaNH2+H2↑ |
您最近一年使用:0次
2021-09-14更新
|
338次组卷
|
5卷引用:黑龙江省哈尔滨市第九中学2021-2022学年高一上学期期中学业阶段性评价考试化学试题
6 . 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
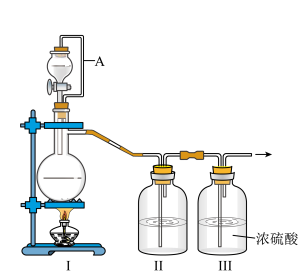
为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________ 。
③装置Ⅶ的作用是________________________________________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净的Cl2 | MnO2 | ① | ② |
| 制备纯净的NO | Cu | ③ | ④ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅶ的作用是
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
2017-03-07更新
|
4682次组卷
|
18卷引用:黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题
黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题高一必修第二册(人教2019版)第五章 素养检测山西省晋城市陵川县高级实验中学2020-2021学年高一下学期3月月考化学试题福建省莆田第六中学2018届高三上学期期中考试化学试题湖北省荆州中学2018届高三4月月考理综化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)甘肃省甘谷县第一中学2019届高三上学期第二次检测考试化学试题陕西省渭南中学2019届高三上学期第三次质量检测化学试题【全国百强校】贵州省遵义航天高级中学2019届高三上学期第四次模拟考试理科综合化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升云南省红河州弥勒市中小学2018-2019学年高二下学期期末考试化学试题山东省枣庄市2021届高三上学期第三次质量检测化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题(已下线)01 以无机物质制备为载体的综合型实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型47 物质制备探究型综合实验



