亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
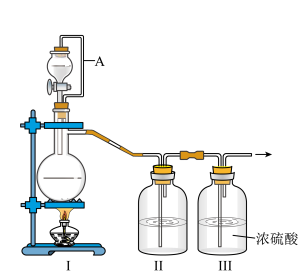
为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________ 。
③装置Ⅶ的作用是________________________________________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净的Cl2 | MnO2 | ① | ② |
| 制备纯净的NO | Cu | ③ | ④ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅶ的作用是
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
17-18高三上·福建莆田·期中 查看更多[18]
福建省莆田第六中学2018届高三上学期期中考试化学试题河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题湖北省荆州中学2018届高三4月月考理综化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题甘肃省甘谷县第一中学2019届高三上学期第二次检测考试化学试题陕西省渭南中学2019届高三上学期第三次质量检测化学试题【全国百强校】贵州省遵义航天高级中学2019届高三上学期第四次模拟考试理科综合化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升云南省红河州弥勒市中小学2018-2019学年高二下学期期末考试化学试题高一必修第二册(人教2019版)第五章 素养检测山东省枣庄市2021届高三上学期第三次质量检测化学试题山西省晋城市陵川县高级实验中学2020-2021学年高一下学期3月月考化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题(已下线)01 以无机物质制备为载体的综合型实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型47 物质制备探究型综合实验
更新时间:2017-03-07 18:28:33
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶的低温硫化剂和粘结剂。查阅资料可知S2Cl2具有下列性质:
(1)实验室可利用硫与少量氯气在 反应制得S2Cl2粗品。
反应制得S2Cl2粗品。
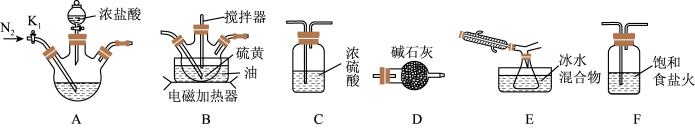
①写出适合A装置制取氯气的离子方程式_______ 。
②请补充完整实验装置连接顺序:A→_______ →D(填写装置标号),其中装置D的作用是_______ 。
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通入氮气,则S2Cl2的产率将_______ (填“偏高”、“偏低”或“无影响”)。
④实验中采用电磁加热方式,而不用酒精灯加热的主要原因是_______ 。实验中为了提高S2Cl2的纯度,实验的关键是控制好温度和_______ 。
(2) S2Cl2遇水强烈反应会产生两种气体和一种沉淀,请写出该反应的化学方程式_______ 。
(3)某同学检验S2Cl2是否含有SCl2杂质进行如下实验:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、 溶液,过滤。
溶液,过滤。
②往①的滤液中加入足量 溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
则产品中氯元素的质量分数为_____ ,由此可知产品中_____ (填“含有”或“不含有”) SCl2杂质。
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | ①300℃以上完全分解 ②氯气过量发生反应: 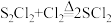 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
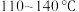 反应制得S2Cl2粗品。
反应制得S2Cl2粗品。
①写出适合A装置制取氯气的离子方程式
②请补充完整实验装置连接顺序:A→
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通入氮气,则S2Cl2的产率将
④实验中采用电磁加热方式,而不用酒精灯加热的主要原因是
(2) S2Cl2遇水强烈反应会产生两种气体和一种沉淀,请写出该反应的化学方程式
(3)某同学检验S2Cl2是否含有SCl2杂质进行如下实验:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、
 溶液,过滤。
溶液,过滤。②往①的滤液中加入足量
 溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
溶液,过滤、洗涤、干燥,称得固体质量为2.87g。则产品中氯元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】为探究氯气的氧化性,某课外小组用下图装置进行实验(夹持仪器已略去,气密性已检验,试管B、C、D中的溶液均为 )
)

(1)写出装置A中制取氯气的化学反应方程式_______ 。
(2)试管D中发生反应的离子方程式为_______ 。
(3)写出试管B中溶液变红色的离子方程式_______ ;_______ 。
(4)为探究试管B中颜色变化的原因,该小组同学进行以下实验:
结论:试管B中红色褪去的原因是_______ 。
(5)为探究试管C中溶液显浅棕色的原因,该小组同学查阅资料并进行实验:
查阅资料: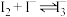 ,
, 在溶液中显棕黄色,能使淀粉变蓝色;碘单质可以被氯气氧化为
在溶液中显棕黄色,能使淀粉变蓝色;碘单质可以被氯气氧化为 (红色)和
(红色)和 (黄色),两种离子可被氧化成
(黄色),两种离子可被氧化成 (无色)。
(无色)。
该小组同学进行实验:
①操作a的实验目的是_______ 。
②实验证明,溶液与氯气反应的最终产物是 。写出氯气与
。写出氯气与 的水溶液反应生成
的水溶液反应生成 的离子方程式
的离子方程式_______ 。
③实验结论:试管C中溶液显浅棕色的原因是_______ 。
 )
)
| 操作 | 现象 |
| 打开活塞,让部分浓盐酸流入烧瓶,加热 | B中溶液变红色,随后红色褪去,溶液显棕黄色 C中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
(2)试管D中发生反应的离子方程式为
(3)写出试管B中溶液变红色的离子方程式
(4)为探究试管B中颜色变化的原因,该小组同学进行以下实验:
| 操作 | 现象 |
取B中的溶液 ,滴加2滴 ,滴加2滴 溶液 溶液 | 溶液仍为棕黄色 |
取B中的溶液 ,滴加2滴 ,滴加2滴 溶液 溶液 | 溶液变红 |
(5)为探究试管C中溶液显浅棕色的原因,该小组同学查阅资料并进行实验:
查阅资料:
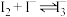 ,
, 在溶液中显棕黄色,能使淀粉变蓝色;碘单质可以被氯气氧化为
在溶液中显棕黄色,能使淀粉变蓝色;碘单质可以被氯气氧化为 (红色)和
(红色)和 (黄色),两种离子可被氧化成
(黄色),两种离子可被氧化成 (无色)。
(无色)。该小组同学进行实验:
| 操作 | 现象 | |
| a. | 取C中的溶液 ,滴入1滴碘水 ,滴入1滴碘水 | 溶液变蓝色 |
取C中的溶液 ,滴入1滴淀粉 ,滴入1滴淀粉 | 溶液没有明显变化 | |
| b. | 取 碘水,滴加1浦淀粉溶液 碘水,滴加1浦淀粉溶液 | 溶液变蓝色 |
| 持续通入氯气 | 蓝色褪去,溶液变为浅棕色,随后溶液变无色,最后溶液略显浅黄绿色。 | |
②实验证明,溶液与氯气反应的最终产物是
 。写出氯气与
。写出氯气与 的水溶液反应生成
的水溶液反应生成 的离子方程式
的离子方程式③实验结论:试管C中溶液显浅棕色的原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】亚硫酰氯( )是一种重要的化工原料,其熔点-105℃,沸点79℃,140℃以上时易分解,遇水剧烈反应生成两种酸性物质。某小组利用反应
)是一种重要的化工原料,其熔点-105℃,沸点79℃,140℃以上时易分解,遇水剧烈反应生成两种酸性物质。某小组利用反应 制备
制备 ,并探究其性质、测定其纯度。
,并探究其性质、测定其纯度。
实验一:制备产品并探究 的性质
的性质
根据图示装置设计实验(装置可以重复使用),已知 遇水易分解。
遇水易分解。

(1)装置接口连接顺序为a→___________ →d、e→___________ →h,碱石灰的作用为___________ 。
(2)实验室用亚硫酸钠固体与70%硫酸制备 ,不用稀硫酸的原因为
,不用稀硫酸的原因为___________ 。
(3)已知 在稍高于沸点的温度下会发生明显的分解,分解产物为
在稍高于沸点的温度下会发生明显的分解,分解产物为 和一种无色刺激性气味气体A和单质气体B,写出化学反应方程式
和一种无色刺激性气味气体A和单质气体B,写出化学反应方程式___________ 。
实验二:测定产品纯度。
在安全的封闭装置内,将产品加入到足量蒸馏水中,待反应完全后,加入足量的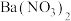 固体,振荡后静置,过滤,将滤液配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,滴几滴
固体,振荡后静置,过滤,将滤液配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,滴几滴 溶液作指示剂,用
溶液作指示剂,用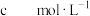
 溶液滴定至终点,消耗V mL
溶液滴定至终点,消耗V mL 溶液[已知:常温下,
溶液[已知:常温下, ,
, 。]
。]
(4)产品中含___________ mol 。下列情况会使测定结果偏高的是
。下列情况会使测定结果偏高的是___________ (填序号)。
①产品含少量 ②滴定管未用
②滴定管未用 溶液润洗
溶液润洗
③滴加 指示剂过多 ④合并溶液时,烧瓶中有少量残余液体
指示剂过多 ④合并溶液时,烧瓶中有少量残余液体
 )是一种重要的化工原料,其熔点-105℃,沸点79℃,140℃以上时易分解,遇水剧烈反应生成两种酸性物质。某小组利用反应
)是一种重要的化工原料,其熔点-105℃,沸点79℃,140℃以上时易分解,遇水剧烈反应生成两种酸性物质。某小组利用反应 制备
制备 ,并探究其性质、测定其纯度。
,并探究其性质、测定其纯度。实验一:制备产品并探究
 的性质
的性质根据图示装置设计实验(装置可以重复使用),已知
 遇水易分解。
遇水易分解。
(1)装置接口连接顺序为a→
(2)实验室用亚硫酸钠固体与70%硫酸制备
 ,不用稀硫酸的原因为
,不用稀硫酸的原因为(3)已知
 在稍高于沸点的温度下会发生明显的分解,分解产物为
在稍高于沸点的温度下会发生明显的分解,分解产物为 和一种无色刺激性气味气体A和单质气体B,写出化学反应方程式
和一种无色刺激性气味气体A和单质气体B,写出化学反应方程式实验二:测定产品纯度。
在安全的封闭装置内,将产品加入到足量蒸馏水中,待反应完全后,加入足量的
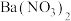 固体,振荡后静置,过滤,将滤液配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,滴几滴
固体,振荡后静置,过滤,将滤液配制成250mL溶液,取25.00mL配制的溶液于锥形瓶,滴几滴 溶液作指示剂,用
溶液作指示剂,用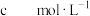
 溶液滴定至终点,消耗V mL
溶液滴定至终点,消耗V mL 溶液[已知:常温下,
溶液[已知:常温下, ,
, 。]
。](4)产品中含
 。下列情况会使测定结果偏高的是
。下列情况会使测定结果偏高的是①产品含少量
 ②滴定管未用
②滴定管未用 溶液润洗
溶液润洗③滴加
 指示剂过多 ④合并溶液时,烧瓶中有少量残余液体
指示剂过多 ④合并溶液时,烧瓶中有少量残余液体
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】亚硝酰氯(NOCl)的沸点为-5.5℃,易水解生成两种酸,常用于有机合成。学习小组在实验室中对NO与 制备NOCl的反应进行了探究。回答下列问题:
制备NOCl的反应进行了探究。回答下列问题:
(1)出于安全和环保考虑,制备反应的实验操作需在______ (条件)下进行。
(2)NO与 反应,装置如图所示(已知
反应,装置如图所示(已知 溶液可以吸收NO)。
溶液可以吸收NO)。

①关闭 ,打开
,打开 和分液漏斗活塞,至气球膨胀,目的为
和分液漏斗活塞,至气球膨胀,目的为______ ;连接B的目的为______ 。
②关闭 ,打开
,打开 ,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为
,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为______ 。
(3)装置E中的试剂X为______ ,作用为______ 。
(4)测定NOCl的纯度。
已知:实验前,D中 的体积为
的体积为 (已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用
(已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用 标准液滴定,达到滴定终点时消耗标准液体积为
标准液滴定,达到滴定终点时消耗标准液体积为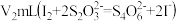 。
。
①NaI发生反应的离子方程式为______ 。
②达到滴定终点的现象为______ 。
③本实验中NOCl的产率为______ 。
 制备NOCl的反应进行了探究。回答下列问题:
制备NOCl的反应进行了探究。回答下列问题:(1)出于安全和环保考虑,制备反应的实验操作需在
(2)NO与
 反应,装置如图所示(已知
反应,装置如图所示(已知 溶液可以吸收NO)。
溶液可以吸收NO)。
①关闭
 ,打开
,打开 和分液漏斗活塞,至气球膨胀,目的为
和分液漏斗活塞,至气球膨胀,目的为②关闭
 ,打开
,打开 ,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为
,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为(3)装置E中的试剂X为
(4)测定NOCl的纯度。
已知:实验前,D中
 的体积为
的体积为 (已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用
(已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用 标准液滴定,达到滴定终点时消耗标准液体积为
标准液滴定,达到滴定终点时消耗标准液体积为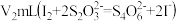 。
。①NaI发生反应的离子方程式为
②达到滴定终点的现象为
③本实验中NOCl的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
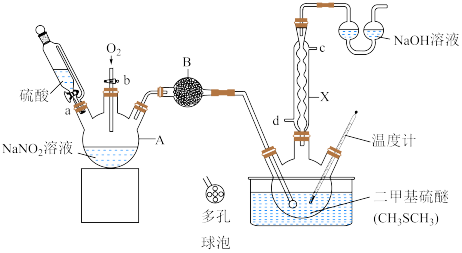
【推荐2】常温下,二甲基亚砜(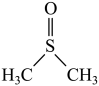 )为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸占为189℃。实验室模拟“
)为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸占为189℃。实验室模拟“ 氧化法”制备二甲基亚砜的装置如图所示(部分夹持装置省略)。
氧化法”制备二甲基亚砜的装置如图所示(部分夹持装置省略)。
已知:①制备二甲基亚砜的反应原理为NO2+CH3SCH3
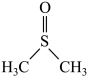 +NO。
+NO。
②二甲基硫醚(CH3SCH3)和二甲基亚砜的密度分别为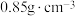 和
和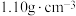 。
。
③ 遇微热易分解为
遇微热易分解为 、
、 和水。
和水。
实验过程:将 仪器中制得的气体通入
仪器中制得的气体通入 二甲基硫醚中,控制温度为60~80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到
二甲基硫醚中,控制温度为60~80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到 二甲基亚砜纯品。回答下列问题:
二甲基亚砜纯品。回答下列问题:
(1) 的名称为
的名称为___________ ;仪器 的进水口为
的进水口为______ (填“ ”或“
”或“ ”)口;
”)口; 中盛放的试剂的目的是干燥
中盛放的试剂的目的是干燥 ,则
,则 中盛放的试剂可能是
中盛放的试剂可能是___________ (填名称)。
(2)通常采用水浴加热来控制温度为60~80℃,该方法的优点是___________ 。
(3)实验中 需过量的原因是
需过量的原因是___________ 。
(4) 溶液吸收尾气中
溶液吸收尾气中 和
和 的化学方程式为
的化学方程式为___________ ,该反应中m(氧化剂):m(还原剂)=___________ 。
(5)本实验的产率是___________ (保留2位小数)%。
 )为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸占为189℃。实验室模拟“
)为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸占为189℃。实验室模拟“ 氧化法”制备二甲基亚砜的装置如图所示(部分夹持装置省略)。
氧化法”制备二甲基亚砜的装置如图所示(部分夹持装置省略)。
已知:①制备二甲基亚砜的反应原理为NO2+CH3SCH3

 +NO。
+NO。②二甲基硫醚(CH3SCH3)和二甲基亚砜的密度分别为
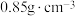 和
和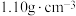 。
。③
 遇微热易分解为
遇微热易分解为 、
、 和水。
和水。实验过程:将
 仪器中制得的气体通入
仪器中制得的气体通入 二甲基硫醚中,控制温度为60~80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到
二甲基硫醚中,控制温度为60~80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到 二甲基亚砜纯品。回答下列问题:
二甲基亚砜纯品。回答下列问题:(1)
 的名称为
的名称为 的进水口为
的进水口为 ”或“
”或“ ”)口;
”)口; 中盛放的试剂的目的是干燥
中盛放的试剂的目的是干燥 ,则
,则 中盛放的试剂可能是
中盛放的试剂可能是(2)通常采用水浴加热来控制温度为60~80℃,该方法的优点是
(3)实验中
 需过量的原因是
需过量的原因是(4)
 溶液吸收尾气中
溶液吸收尾气中 和
和 的化学方程式为
的化学方程式为(5)本实验的产率是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:

(1)B中发生反应的化学方程式是______________________________ 。
(2)证明氨气发生催化氧化的现象是________________ ,反应的方程式是________________ 。
(3)E中铜发生反应的离子方程式是________________________________ 。
(4)E中缓缓通入空气的目的是____________________________________ 。

(1)B中发生反应的化学方程式是
(2)证明氨气发生催化氧化的现象是
(3)E中铜发生反应的离子方程式是
(4)E中缓缓通入空气的目的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】食品级焦亚硫酸钠( )常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。实验室制备少量
)常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。实验室制备少量 的实验流程如下:
的实验流程如下:

回答下列问题:
(1)步骤I制取并收集干燥的 ,所用装置如图所示:
,所用装置如图所示:

①按气流方向连接各仪器口,顺序为a___________ (填标号)。
②装置C的作用是___________ ,装置E中试剂是______________________ 。
(2)步骤II发生反应的化学方程式为______________________ ;该步骤加热时采取的方式为___________ 。
(3)操作III:低温蒸发、___________ 、洗涤;其中洗涤 时依次用饱和
时依次用饱和 水溶液、无水乙醇。饱和
水溶液、无水乙醇。饱和 水溶液洗涤的目的是
水溶液洗涤的目的是_________________________________ 。
(4)实验制得的 固体中含有少量
固体中含有少量 杂质,其可能的原因是
杂质,其可能的原因是______________________ 。
(5) 纯度测定:取
纯度测定:取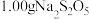 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 该溶液,用
该溶液,用 的碘标准溶液滴定至终点,消耗
的碘标准溶液滴定至终点,消耗 标准溶液。样品中
标准溶液。样品中 的质量分数为
的质量分数为___________ (假设其他杂质不反应,滴定过程中发生反应的离子方程式为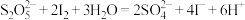 )。
)。
 )常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。实验室制备少量
)常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。实验室制备少量 的实验流程如下:
的实验流程如下:
回答下列问题:
(1)步骤I制取并收集干燥的
 ,所用装置如图所示:
,所用装置如图所示:
①按气流方向连接各仪器口,顺序为a
②装置C的作用是
(2)步骤II发生反应的化学方程式为
(3)操作III:低温蒸发、
 时依次用饱和
时依次用饱和 水溶液、无水乙醇。饱和
水溶液、无水乙醇。饱和 水溶液洗涤的目的是
水溶液洗涤的目的是(4)实验制得的
 固体中含有少量
固体中含有少量 杂质,其可能的原因是
杂质,其可能的原因是(5)
 纯度测定:取
纯度测定:取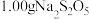 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 该溶液,用
该溶液,用 的碘标准溶液滴定至终点,消耗
的碘标准溶液滴定至终点,消耗 标准溶液。样品中
标准溶液。样品中 的质量分数为
的质量分数为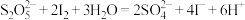 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20→NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
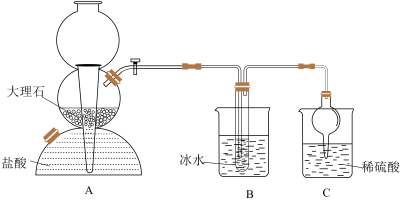
(1)A装置中所发生反应的离子方程式为____ C装置的作用为___
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);
参照表中数据,请分析B装置中使用冰水的目的是__________________________
(3)该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在_______ 装置之间(填写字母)连接一个盛有 ________ 的洗气装置,其作用 _______________ 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为____________________ 。

(1)A装置中所发生反应的离子方程式为
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);
温度 溶解度 | 0 | 10 | 20 | 30 | 40 | 50 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水的目的是
(3)该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图:
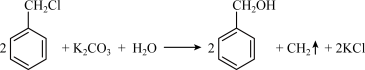
实验步骤:如图所示,在装有电动搅拌器的250mL三颈烧瓶里加入9.0g碳酸钾(过量),70.0mL水,加热溶解,再加入2.0mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0mL氯化苄。搅拌加热回流反应1~1.5h。反应结束后冷却,并转入125mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208℃的馏分,得8.4mL苯甲醇。
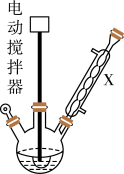
回答下列问题:
(1)仪器X的名称是___ ,冷却水应从___ (填“上口”或“下口”)通入。由于苯甲醇的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是___ (填字母)。

(2)本实验中加入无水硫酸镁的目的是___ 。从绿色化学角度考虑,萃取剂宜采用___ (填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法___ (填“是”或“否”)正确,其理由是___ 。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是___ 。
(5)本实验苯甲醇的产率为___ %(计算结果保留一位小数)。
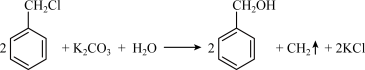
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 | |
氯化苄 | 126.5 | -43 | 179.4 | 1.1 | 不溶 |
碳酸钾 | 138 | 891 | — | 2.4 | 易溶 |
四乙基溴化铵 | — | — | — | — | 易溶 |
苯甲醇 | 108 | -15.3 | 205.3 | 1.0 | 易溶 |

回答下列问题:
(1)仪器X的名称是

(2)本实验中加入无水硫酸镁的目的是
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是
(5)本实验苯甲醇的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】硫酸四氨合铜晶体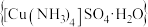 常用作杀虫剂、媒染剂,也是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线为
常用作杀虫剂、媒染剂,也是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线为
已知: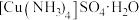 为绛蓝色晶体,常温下在空气中易与水和二氧化碳反应,生成铜的碱式盐使晶体变成绿色的粉末。在溶液中存在以下电离
为绛蓝色晶体,常温下在空气中易与水和二氧化碳反应,生成铜的碱式盐使晶体变成绿色的粉末。在溶液中存在以下电离 解离
解离 过程:
过程:
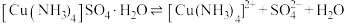 ,
,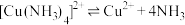
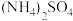 及
及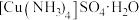 在水中均可溶,在乙醇中均难溶。
在水中均可溶,在乙醇中均难溶。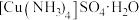 在乙醇和水的混合溶剂中的溶解度随乙醇体积分数的增大而减小。若在铜氨溶液中加入乙醇,会析出绛蓝色的硫酸四氨合铜晶体;实验表明,若在铜氨溶液中加入硫酸铵或硫酸钠,同样会有硫酸四氨合铜晶体析出。
在乙醇和水的混合溶剂中的溶解度随乙醇体积分数的增大而减小。若在铜氨溶液中加入乙醇,会析出绛蓝色的硫酸四氨合铜晶体;实验表明,若在铜氨溶液中加入硫酸铵或硫酸钠,同样会有硫酸四氨合铜晶体析出。
回答下列问题:
(1)实验室通常采用将铜屑浸泡在热的稀硫酸中,然后向其中不断通入热空气的方法来制备 溶液。
溶液。
 写出制备
写出制备 溶液时发生反应的离子方程式:
溶液时发生反应的离子方程式:________________________ 。
 为了使制备过程中稀硫酸的温度保持在
为了使制备过程中稀硫酸的温度保持在 ,需要对稀硫酸进行加热保温。应该采用的加热方式为
,需要对稀硫酸进行加热保温。应该采用的加热方式为________ ,该加热方式的优点为________________________ 。
(2)方案 向溶液
向溶液 中所加的固体试剂为
中所加的固体试剂为________  填
填 种试剂的化学式
种试剂的化学式 ;试说明为何加入该固体试剂后会有
;试说明为何加入该固体试剂后会有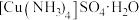 晶体析出:
晶体析出:________________________ 。
(3)方案 的实验步骤为
的实验步骤为 加热蒸发,
加热蒸发, 冷却溶液,
冷却溶液, 加
加 乙醇、结晶
乙醇、结晶 。
。
该方案存在一定缺陷,因为利用方案 得到的产品晶体中往往含有
得到的产品晶体中往往含有________ 杂质,产生杂质的原因是________________ 。
(4)方案 、
、 的最后操作步骤均为过滤、洗涤、干燥。
的最后操作步骤均为过滤、洗涤、干燥。
 过滤操作的主要目的是将固液混合物进行分离。中学化学中常见的用于固液混合物分离的操作有“倾析法”“普通过滤”和“减压过滤”等,操作示意图如下:
过滤操作的主要目的是将固液混合物进行分离。中学化学中常见的用于固液混合物分离的操作有“倾析法”“普通过滤”和“减压过滤”等,操作示意图如下:

减压过滤相对于普通过滤的优点为________  填字母下同
填字母下同 。
。
A.过滤速度相对较快
B.能过滤胶状混合物
C.得到的固体物质相对比较干燥
D.可以过滤具有强腐蚀性的固液混合物
 洗涤步骤中可选用的洗涤液是
洗涤步骤中可选用的洗涤液是________ 。
A.乙醇与乙醚的混合液 蒸馏水
蒸馏水
C.乙醇和水的混合液 饱和硫酸钠溶液
饱和硫酸钠溶液
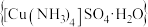 常用作杀虫剂、媒染剂,也是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线为
常用作杀虫剂、媒染剂,也是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线为
已知:
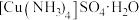 为绛蓝色晶体,常温下在空气中易与水和二氧化碳反应,生成铜的碱式盐使晶体变成绿色的粉末。在溶液中存在以下电离
为绛蓝色晶体,常温下在空气中易与水和二氧化碳反应,生成铜的碱式盐使晶体变成绿色的粉末。在溶液中存在以下电离 解离
解离 过程:
过程: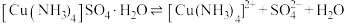 ,
,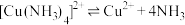
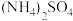 及
及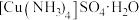 在水中均可溶,在乙醇中均难溶。
在水中均可溶,在乙醇中均难溶。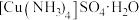 在乙醇和水的混合溶剂中的溶解度随乙醇体积分数的增大而减小。若在铜氨溶液中加入乙醇,会析出绛蓝色的硫酸四氨合铜晶体;实验表明,若在铜氨溶液中加入硫酸铵或硫酸钠,同样会有硫酸四氨合铜晶体析出。
在乙醇和水的混合溶剂中的溶解度随乙醇体积分数的增大而减小。若在铜氨溶液中加入乙醇,会析出绛蓝色的硫酸四氨合铜晶体;实验表明,若在铜氨溶液中加入硫酸铵或硫酸钠,同样会有硫酸四氨合铜晶体析出。回答下列问题:
(1)实验室通常采用将铜屑浸泡在热的稀硫酸中,然后向其中不断通入热空气的方法来制备
 溶液。
溶液。 写出制备
写出制备 溶液时发生反应的离子方程式:
溶液时发生反应的离子方程式: 为了使制备过程中稀硫酸的温度保持在
为了使制备过程中稀硫酸的温度保持在 ,需要对稀硫酸进行加热保温。应该采用的加热方式为
,需要对稀硫酸进行加热保温。应该采用的加热方式为(2)方案
 向溶液
向溶液 中所加的固体试剂为
中所加的固体试剂为 填
填 种试剂的化学式
种试剂的化学式 ;试说明为何加入该固体试剂后会有
;试说明为何加入该固体试剂后会有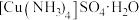 晶体析出:
晶体析出:(3)方案
 的实验步骤为
的实验步骤为 加热蒸发,
加热蒸发, 冷却溶液,
冷却溶液, 加
加 乙醇、结晶
乙醇、结晶 。
。该方案存在一定缺陷,因为利用方案
 得到的产品晶体中往往含有
得到的产品晶体中往往含有(4)方案
 、
、 的最后操作步骤均为过滤、洗涤、干燥。
的最后操作步骤均为过滤、洗涤、干燥。 过滤操作的主要目的是将固液混合物进行分离。中学化学中常见的用于固液混合物分离的操作有“倾析法”“普通过滤”和“减压过滤”等,操作示意图如下:
过滤操作的主要目的是将固液混合物进行分离。中学化学中常见的用于固液混合物分离的操作有“倾析法”“普通过滤”和“减压过滤”等,操作示意图如下:
减压过滤相对于普通过滤的优点为
 填字母下同
填字母下同 。
。A.过滤速度相对较快
B.能过滤胶状混合物
C.得到的固体物质相对比较干燥
D.可以过滤具有强腐蚀性的固液混合物
 洗涤步骤中可选用的洗涤液是
洗涤步骤中可选用的洗涤液是A.乙醇与乙醚的混合液
 蒸馏水
蒸馏水C.乙醇和水的混合液
 饱和硫酸钠溶液
饱和硫酸钠溶液
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
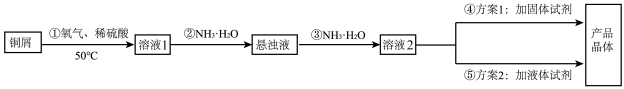
【推荐2】MnSO4•H2O是电解锰及其他锰盐的原料,也是饲料中常用的添加剂。某化学兴趣小组设计如图甲实验装置制备MnSO4•H2O,并研究硫酸锰的某些性质:
①MnSO4•H2O是一种浅粉色晶体,易溶于水,不溶于乙醇;
②硫酸锰高温下的分解产物为MnxOy、SO2及SO3;
③硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如图乙所示。
①A装置中仪器a名称是_____ ,b导管的作用是_____ 。
②A装置发生的化学反应方程式是_____ ,B装置中多孔球泡的作用是_____ 。
③反应后从MnSO4溶液得到固体MnSO4•H2O的操作为控制温度在80~90℃之间蒸发结晶,_____ ,使固体MnSO4•H2O与溶液分离,_____ ,真空干燥。
(2)检验Mn2+:实验室常用铋酸钠(一种不溶于水的淡黄色晶体)检验Mn2+是否存在,往待测液中加入NaBiO3晶体,加硫酸酸化,反应后得到Bi3+同时溶液变为紫红色,则证明待测液中存在Mn2+,该反应的离子方程式为_____ 。
(3)究MnSO4高温分解的固体产物:为了确定MnxOy的化学式,用如图所示装置进行实验。_____ (填序号)。_____ 。

①MnSO4•H2O是一种浅粉色晶体,易溶于水,不溶于乙醇;
②硫酸锰高温下的分解产物为MnxOy、SO2及SO3;
③硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如图乙所示。

①A装置中仪器a名称是
②A装置发生的化学反应方程式是
③反应后从MnSO4溶液得到固体MnSO4•H2O的操作为控制温度在80~90℃之间蒸发结晶,
(2)检验Mn2+:实验室常用铋酸钠(一种不溶于水的淡黄色晶体)检验Mn2+是否存在,往待测液中加入NaBiO3晶体,加硫酸酸化,反应后得到Bi3+同时溶液变为紫红色,则证明待测液中存在Mn2+,该反应的离子方程式为
(3)究MnSO4高温分解的固体产物:为了确定MnxOy的化学式,用如图所示装置进行实验。

A. B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】氮化镓是一种新型的半导体,常用于紫光的激光二极管(LED)。某小组以废旧薄膜太阳能电池(CIGS)为原料(主要成分为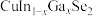 )制备氮化镓,工艺流程如图:
)制备氮化镓,工艺流程如图:

已知:①硒属于氧族元素,镓、铟与铝位于同主族;
②氨水过量时, ;
;
③常温下,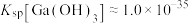 ,
,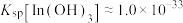 ,
,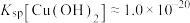 。当金属离子浓度
。当金属离子浓度 时认为金属离子已完全沉淀。
时认为金属离子已完全沉淀。
回答下列问题:
(1)“烧渣”的主要成分是 、
、 和
和 ,已知
,已知 ,在“高温焙烧”条件下,CIGS与氧气反应时铜转化成
,在“高温焙烧”条件下,CIGS与氧气反应时铜转化成 ,不生成CuO,其主要原因可能是
,不生成CuO,其主要原因可能是___________ (用结构理论解释)。“双氧水”的作用是___________ (用离子方程式表示)。
(2)“调pH过滤”后的“滤渣”主要成分是___________ (填化学式)。
(3)“回流过滤”中 的作用是
的作用是___________ (用镓相关的化学方程式表示)。“滤液I”加入足量烧碱,加热可以制备一种气体,该气体可以用于上述“___________ ”工序(填名称)。
(4)在一定硫酸和双氧水、固体颗粒不变的条件下,单位时间内“酸浸氧化”率与温度的关系如图甲所示(氧化率等于被氧化的元素质量与该元素总质量之比)。30℃时达到峰值的原因是___________ 。
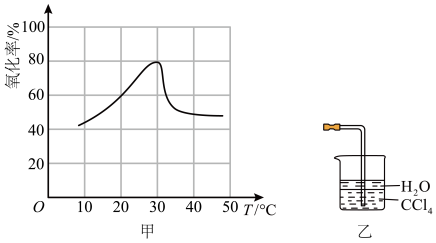
(5)“高温气相沉积”中尾气常选用如图乙所示装置吸收,其原理是___________ 。
(6)已知“浸出液”中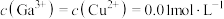 。在“调pH过滤”中
。在“调pH过滤”中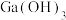 完全沉淀时,
完全沉淀时, 是否开始沉淀:
是否开始沉淀:___________ (写出计算过程)。
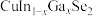 )制备氮化镓,工艺流程如图:
)制备氮化镓,工艺流程如图:
已知:①硒属于氧族元素,镓、铟与铝位于同主族;
②氨水过量时,
 ;
;③常温下,
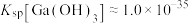 ,
,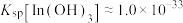 ,
,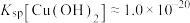 。当金属离子浓度
。当金属离子浓度 时认为金属离子已完全沉淀。
时认为金属离子已完全沉淀。回答下列问题:
(1)“烧渣”的主要成分是
 、
、 和
和 ,已知
,已知 ,在“高温焙烧”条件下,CIGS与氧气反应时铜转化成
,在“高温焙烧”条件下,CIGS与氧气反应时铜转化成 ,不生成CuO,其主要原因可能是
,不生成CuO,其主要原因可能是(2)“调pH过滤”后的“滤渣”主要成分是
(3)“回流过滤”中
 的作用是
的作用是(4)在一定硫酸和双氧水、固体颗粒不变的条件下,单位时间内“酸浸氧化”率与温度的关系如图甲所示(氧化率等于被氧化的元素质量与该元素总质量之比)。30℃时达到峰值的原因是

(5)“高温气相沉积”中尾气常选用如图乙所示装置吸收,其原理是
(6)已知“浸出液”中
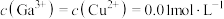 。在“调pH过滤”中
。在“调pH过滤”中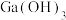 完全沉淀时,
完全沉淀时, 是否开始沉淀:
是否开始沉淀:
您最近一年使用:0次



