解题方法
1 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料工业上可由天然二氧化锰粉与硫化锰矿(主要成分为 ,还含
,还含 等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
等元素的氧化物)制备,工艺流程如图所示。回答下列问题:

相关金属离子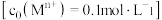 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:
(1)已知“溶浸”中发生反应的化学方程式为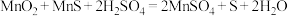 ,当生成
,当生成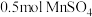 时,该反应中转移
时,该反应中转移___________  电子,该反应中n(还原剂):n(氧化剂)=
电子,该反应中n(还原剂):n(氧化剂)=___________ ,“滤渣1”的主要成分为___________ (填化学式)
(2)“氧化”中添加适量的 的作用是将
的作用是将 氧化为
氧化为 ,酸性条件下
,酸性条件下 氧化
氧化 反应的离子方程式为
反应的离子方程式为___________ (已知: 被还原为
被还原为 )。
)。
(3)“除杂1”的目的是除去 和
和 ,“除杂2”的目的是将
,“除杂2”的目的是将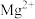 转化为
转化为 沉淀从而除去
沉淀从而除去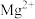 ﹐试推测“调
﹐试推测“调 ”是为了除
”是为了除___________ (填元素符号),溶液的 范围应调节在
范围应调节在___________ ~6(当某金属离子沉淀完全视作该金属离子已除净)。
(4)写出“沉锰”时发生反应的离子方程式:___________ 。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为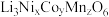 ,其中
,其中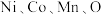 的化合价依次为
的化合价依次为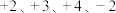 。当
。当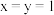 时,
时,
___________ ,试用氧化物的形式表示镍钴锰三元材料:___________ [某些含氧酸盐可以写成氧化物的形式(例如: 可以表示为
可以表示为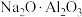 )]。
)]。
 ,还含
,还含 等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
相关金属离子
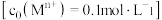 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:| 金属离子 |  |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
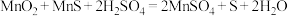 ,当生成
,当生成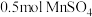 时,该反应中转移
时,该反应中转移 电子,该反应中n(还原剂):n(氧化剂)=
电子,该反应中n(还原剂):n(氧化剂)=(2)“氧化”中添加适量的
 的作用是将
的作用是将 氧化为
氧化为 ,酸性条件下
,酸性条件下 氧化
氧化 反应的离子方程式为
反应的离子方程式为 被还原为
被还原为 )。
)。(3)“除杂1”的目的是除去
 和
和 ,“除杂2”的目的是将
,“除杂2”的目的是将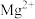 转化为
转化为 沉淀从而除去
沉淀从而除去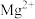 ﹐试推测“调
﹐试推测“调 ”是为了除
”是为了除 范围应调节在
范围应调节在(4)写出“沉锰”时发生反应的离子方程式:
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为
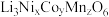 ,其中
,其中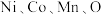 的化合价依次为
的化合价依次为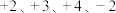 。当
。当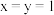 时,
时,
 可以表示为
可以表示为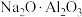 )]。
)]。
您最近一年使用:0次
2023-07-04更新
|
143次组卷
|
2卷引用:河北省保定市2022~2023学年高一下学期期末调研考试化学试题
2021高三·全国·专题练习
名校
解题方法
2 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是___________ (填化学式)。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是
您最近一年使用:0次
名校
3 . 氮肥的使用极大提高了粮食作物的产量,对解决世界粮食危机起到了不可或缺的作用,下面是几种通过氮的固定制备氮肥的方法。
(1)自然固氮:一种途径是通过雷电将空气中少量的氮气转化为含氮化合物(氮肥),主要转化途径如下(转化所需试剂及条件已略去):
 硝酸盐[如
硝酸盐[如 ]
]
①写出在空气中 转化为NO的化学方程式
转化为NO的化学方程式_______ 。
②将 转化为
转化为 ,列举两种不同类别的化合物M
,列举两种不同类别的化合物M_______ (写化学式)。
③若M是Cu单质,与稀硝酸反应也能生成硝酸盐,写出铜粉与稀硝酸反应的离子方程式_______ 。
(2)人工固氮:
①工业上以氮气和氢气为原料,在高温、高压和催化剂的条件下合成氨。该反应的化学方程式为_______ 。
②利用氨气与氧气在催化剂作用下生成NO,是工业制备硝酸的重要环节,该反应中NO是_______ (填“氧化产物”“还原产物”或“氧化产物和还原产物”)。
③利用氨气与二氧化碳在催化剂作用下合成重要氮肥尿素 ,尿素中N元素的化合价是
,尿素中N元素的化合价是_______ 。合成尿素的化学方程式_______ 。尿素在土壤中与水结合生成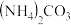 ,被植物吸收,有利于作物的生长。
,被植物吸收,有利于作物的生长。
(3)在微生物作用下实现 的转化,称为硝化过程。在一定条件下,
的转化,称为硝化过程。在一定条件下, 被
被 氧化成
氧化成 ,参加反应的
,参加反应的 和
和 的物质的量之比为
的物质的量之比为_______ 。由于 有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
(4)有同学猜测,在 被细菌分解过程中,
被细菌分解过程中, 最终分解为
最终分解为 ,同时有
,同时有 生成。从化合价变化的角度分析有
生成。从化合价变化的角度分析有 生成的合理性
生成的合理性_______ 。
(1)自然固氮:一种途径是通过雷电将空气中少量的氮气转化为含氮化合物(氮肥),主要转化途径如下(转化所需试剂及条件已略去):
 硝酸盐[如
硝酸盐[如 ]
]①写出在空气中
 转化为NO的化学方程式
转化为NO的化学方程式②将
 转化为
转化为 ,列举两种不同类别的化合物M
,列举两种不同类别的化合物M③若M是Cu单质,与稀硝酸反应也能生成硝酸盐,写出铜粉与稀硝酸反应的离子方程式
(2)人工固氮:
①工业上以氮气和氢气为原料,在高温、高压和催化剂的条件下合成氨。该反应的化学方程式为
②利用氨气与氧气在催化剂作用下生成NO,是工业制备硝酸的重要环节,该反应中NO是
③利用氨气与二氧化碳在催化剂作用下合成重要氮肥尿素
 ,尿素中N元素的化合价是
,尿素中N元素的化合价是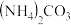 ,被植物吸收,有利于作物的生长。
,被植物吸收,有利于作物的生长。(3)在微生物作用下实现
 的转化,称为硝化过程。在一定条件下,
的转化,称为硝化过程。在一定条件下, 被
被 氧化成
氧化成 ,参加反应的
,参加反应的 和
和 的物质的量之比为
的物质的量之比为 有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。(4)有同学猜测,在
 被细菌分解过程中,
被细菌分解过程中, 最终分解为
最终分解为 ,同时有
,同时有 生成。从化合价变化的角度分析有
生成。从化合价变化的角度分析有 生成的合理性
生成的合理性
您最近一年使用:0次
解题方法
4 . 贫血的常用补铁剂.—葡萄糖酸亚铁[ ,易溶于水,
,易溶于水,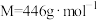 ]的合成前体是碳酸亚铁
]的合成前体是碳酸亚铁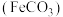 ,某实验小组用如图所示装置制备碳酸亚铁。
,某实验小组用如图所示装置制备碳酸亚铁。
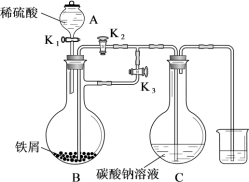
请回答下列问题:
(1)仪器A的名称为_______ ,仪器B中发生反应的离子方程式为_______ 。
(2)开始实验时,三个活塞的操作为先打开 和
和_______ (填“ ”或“
”或“ ”,下同),并关闭
”,下同),并关闭_______ ,这样操作的原因是_______ 。
(3)反应一段时间后,使蒸馏烧瓶中生成的硫酸亚铁溶液进入仪器C中的操作是_______ 。若碳酸亚铁置于空气中的时间过长,其表面呈红褐色,分析表面呈红褐色的原因:_______ 。(用化学方程式回答)
(4)以碳酸亚铁和葡萄糖酸为原料制备葡萄糖酸亚铁的反应方程式如下: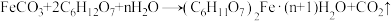 。为测定某
。为测定某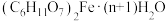 样品中n的值,现称取
样品中n的值,现称取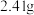 该晶体,在氢气气流中加热至完全分解,最终得到
该晶体,在氢气气流中加热至完全分解,最终得到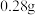 铁单质,则
铁单质,则
_______ 。
 ,易溶于水,
,易溶于水,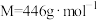 ]的合成前体是碳酸亚铁
]的合成前体是碳酸亚铁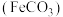 ,某实验小组用如图所示装置制备碳酸亚铁。
,某实验小组用如图所示装置制备碳酸亚铁。
请回答下列问题:
(1)仪器A的名称为
(2)开始实验时,三个活塞的操作为先打开
 和
和 ”或“
”或“ ”,下同),并关闭
”,下同),并关闭(3)反应一段时间后,使蒸馏烧瓶中生成的硫酸亚铁溶液进入仪器C中的操作是
(4)以碳酸亚铁和葡萄糖酸为原料制备葡萄糖酸亚铁的反应方程式如下:
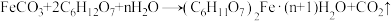 。为测定某
。为测定某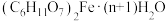 样品中n的值,现称取
样品中n的值,现称取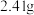 该晶体,在氢气气流中加热至完全分解,最终得到
该晶体,在氢气气流中加热至完全分解,最终得到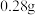 铁单质,则
铁单质,则
您最近一年使用:0次
5 . 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
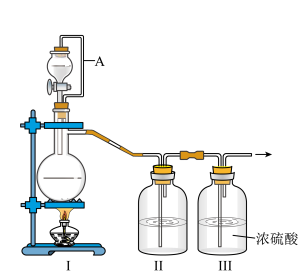
为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________ 。
③装置Ⅶ的作用是________________________________________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净的Cl2 | MnO2 | ① | ② |
| 制备纯净的NO | Cu | ③ | ④ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅶ的作用是
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
2017-03-07更新
|
4682次组卷
|
18卷引用:河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题
河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题高一必修第二册(人教2019版)第五章 素养检测山西省晋城市陵川县高级实验中学2020-2021学年高一下学期3月月考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题福建省莆田第六中学2018届高三上学期期中考试化学试题湖北省荆州中学2018届高三4月月考理综化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题甘肃省甘谷县第一中学2019届高三上学期第二次检测考试化学试题陕西省渭南中学2019届高三上学期第三次质量检测化学试题【全国百强校】贵州省遵义航天高级中学2019届高三上学期第四次模拟考试理科综合化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升云南省红河州弥勒市中小学2018-2019学年高二下学期期末考试化学试题山东省枣庄市2021届高三上学期第三次质量检测化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题(已下线)01 以无机物质制备为载体的综合型实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型47 物质制备探究型综合实验



