名校
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取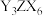 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性: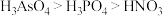
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。

利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取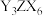 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
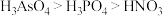
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
2022-07-29更新
|
1154次组卷
|
3卷引用:湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题
湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题
2 . 氢化铝钠 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。

某实验小组利用如图所示的装置制备无水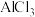 。
。

(1)装置F的作用是_____________________________ 。
(2)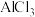 与NaH反应时,需将
与NaH反应时,需将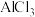 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为_____________________________
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。

从简约性、准确性角度考虑,最适宜的装置是___________ 。
 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
某实验小组利用如图所示的装置制备无水
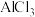 。
。
(1)装置F的作用是
(2)
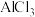 与NaH反应时,需将
与NaH反应时,需将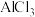 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 (3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。

从简约性、准确性角度考虑,最适宜的装置是
您最近一年使用:0次
3 . 莽草酸能够通过抑制血小板聚集、防止脑血栓的形成,下图是合成莽草酸的路线(部分反应条件和步骤已略去),回答下列问题。___________ ,该物质可发生加聚反应,其产物的结构简式为___________ 。
(2)物质D中含氧官能团的名称为___________ 。
(3)莽草酸的化学式为___________ ,莽草酸与足量NaOH溶液反应的化学方程式为___________ 。
(4)一定条件下莽草酸与酸R可生成酯(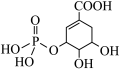 ),根据酯化反应原理可知酸R为
),根据酯化反应原理可知酸R为___________ (写化学式)。
(5)A与 发生加成反应的产物M与G互为同系物,G的相对分子质量比M大28.则符合条件的G有
发生加成反应的产物M与G互为同系物,G的相对分子质量比M大28.则符合条件的G有___________ 种。

已知:在有机化学中也可用键线式表示有机物的结构,如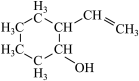 可简写为
可简写为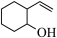
(2)物质D中含氧官能团的名称为
(3)莽草酸的化学式为
(4)一定条件下莽草酸与酸R可生成酯(
 ),根据酯化反应原理可知酸R为
),根据酯化反应原理可知酸R为(5)A与
 发生加成反应的产物M与G互为同系物,G的相对分子质量比M大28.则符合条件的G有
发生加成反应的产物M与G互为同系物,G的相对分子质量比M大28.则符合条件的G有
您最近一年使用:0次
4 . 近年来,乳酸成为研究热点之一、乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。以乳酸(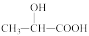 )为原料制成的高分子材料具有生物相容性,而且在哺乳动物体内或自然环境中都可以最终降解为二氧化碳和水。乳酸还有许多其他用途,如它能与铁粉反应制备一种药物,反应的化学方程式为:2
)为原料制成的高分子材料具有生物相容性,而且在哺乳动物体内或自然环境中都可以最终降解为二氧化碳和水。乳酸还有许多其他用途,如它能与铁粉反应制备一种药物,反应的化学方程式为:2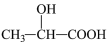 +Fe
+Fe
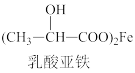 +X。
+X。
(1)乳酸降解为二氧化碳的反应的化学方程式为_______ 。
(2)乳酸与铁的反应中,X的化学式为_______ ,该反应中乳酸表现出酸性和_______ 性。
(3)试从自然界物质循环的角度解释利用乳酸合成高分子材料对环境的重要意义_______ 。
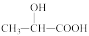 )为原料制成的高分子材料具有生物相容性,而且在哺乳动物体内或自然环境中都可以最终降解为二氧化碳和水。乳酸还有许多其他用途,如它能与铁粉反应制备一种药物,反应的化学方程式为:2
)为原料制成的高分子材料具有生物相容性,而且在哺乳动物体内或自然环境中都可以最终降解为二氧化碳和水。乳酸还有许多其他用途,如它能与铁粉反应制备一种药物,反应的化学方程式为:2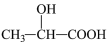 +Fe
+Fe
 +X。
+X。(1)乳酸降解为二氧化碳的反应的化学方程式为
(2)乳酸与铁的反应中,X的化学式为
(3)试从自然界物质循环的角度解释利用乳酸合成高分子材料对环境的重要意义
您最近一年使用:0次
2022-11-26更新
|
158次组卷
|
2卷引用:2019版鲁科化学必修第二册第3章本章自我评价课后习题
5 . 申泮文院士(1916-2017),广东籍化学家、教育家,长期致力于无机化学教学研究为我国无机化学教学和教材建设做出了卓越贡献。他在化学教育研究领域创下多项第一;编写出新中国第一部大学化学教材、第一个引入美国科技出版物、第一个在化学教学应用计算机技术、主持完成我国第一部多媒体教科书等。他常在课堂教学中,号召学生牢记历史,报效祖国。2005年,申先生入选“中国10位最令人感动的教师”,也是我国执教时间最长的化学教师。2011年,95岁高龄的申先生还坚持骑着行车去给本科生讲课。
申先生是我国在离子型金属氢化物、储氢合金材料和镍/金属氢化物可逆电池等研究领域的先驱者。1959年10月,他和龚毅生等在《化学通报》发表“氢化铝锂的合成”,这是我国在氢化物研究领域发表的第一篇论文。
(1)完成以氢化锂(LiH)和氯化铝为原料合成氢化铝锂(LiAlH4)的反应方程式:
4LiH+______ =LiAlH4+3______
(2)根据以上材料谈一谈你的认识和启示______ 、______ 、______ (写三点)。
申先生是我国在离子型金属氢化物、储氢合金材料和镍/金属氢化物可逆电池等研究领域的先驱者。1959年10月,他和龚毅生等在《化学通报》发表“氢化铝锂的合成”,这是我国在氢化物研究领域发表的第一篇论文。
(1)完成以氢化锂(LiH)和氯化铝为原料合成氢化铝锂(LiAlH4)的反应方程式:
4LiH+
(2)根据以上材料谈一谈你的认识和启示
您最近一年使用:0次
名校
6 . 氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒,农药的生产、药物的合成等领域都有着重要的应用。
Ⅰ.(1)NaClO中Cl的化合价为____ ,NaClO具有较强的_____ (填“氧化”或“还原”)性,是常用的消毒剂和漂白剂的有效成分。
(2)黄色气体 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。
① 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 、
、 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为________________ 。
② 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下反应制取氯气,写出该反应的化学方程式______________ 。
(2)C装置的作用是______________ 。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成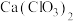 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是______________ 。
②另一个副反应 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为________________ 。
Ⅰ.(1)NaClO中Cl的化合价为
(2)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 、
、 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下反应制取氯气,写出该反应的化学方程式
(2)C装置的作用是
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成
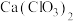 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②另一个副反应
 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为
您最近一年使用:0次
2020-10-07更新
|
426次组卷
|
3卷引用:人教版(2019)高一必修第一册第二章 海水中的重要元素 素养拓展区
解题方法
7 . 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理_ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是__ ,反应的离子方程式为_ 。
(3)实验室溶解该熔融物,下列试剂中最好的是__ (填序号),并说明理由:__ 。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)实验室溶解该熔融物,下列试剂中最好的是
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
您最近一年使用:0次
8 . 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
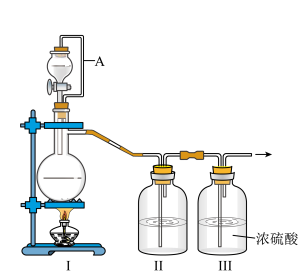
为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________ 。
③装置Ⅶ的作用是________________________________________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净的Cl2 | MnO2 | ① | ② |
| 制备纯净的NO | Cu | ③ | ④ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅶ的作用是
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
2017-03-07更新
|
4682次组卷
|
18卷引用:河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题
河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题高一必修第二册(人教2019版)第五章 素养检测山西省晋城市陵川县高级实验中学2020-2021学年高一下学期3月月考化学试题湖北省荆州中学2018届高三4月月考理综化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题陕西省渭南中学2019届高三上学期第三次质量检测化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题(已下线)01 以无机物质制备为载体的综合型实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型47 物质制备探究型综合实验福建省莆田第六中学2018届高三上学期期中考试化学试题甘肃省甘谷县第一中学2019届高三上学期第二次检测考试化学试题【全国百强校】贵州省遵义航天高级中学2019届高三上学期第四次模拟考试理科综合化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题云南省红河州弥勒市中小学2018-2019学年高二下学期期末考试化学试题山东省枣庄市2021届高三上学期第三次质量检测化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题



