解题方法
1 . 某实验小组以含铁污泥(主要成分为 、
、 及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾
及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾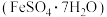 和柠檬酸铁铵。
和柠檬酸铁铵。
(1)写出“酸浸”时, 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:___________ 。
(2)“滤液X”中含有的阳离子为___________ 。
(3)路线I中,加入 溶液的目的是
溶液的目的是___________ 。
(4)写出加入氨水“沉淀”时的离子方程式:___________ 。
(5)写出加入过量铁粉时发生反应的离子方程式:___________ 、___________ 。
(6)“酸浸”时加入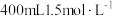 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为___________ g。
 、
、 及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾
及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾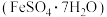 和柠檬酸铁铵。
和柠檬酸铁铵。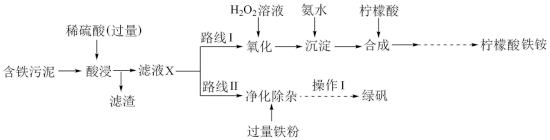
(1)写出“酸浸”时,
 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:(2)“滤液X”中含有的阳离子为
(3)路线I中,加入
 溶液的目的是
溶液的目的是(4)写出加入氨水“沉淀”时的离子方程式:
(5)写出加入过量铁粉时发生反应的离子方程式:
(6)“酸浸”时加入
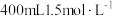 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
您最近一年使用:0次
名校
2 . 化学使生活更美好。下列有关说法不正确的是
| A.2021年9月24日我国科学家在实验室首次实现了从二氧化碳到淀粉分子的全合成,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路 |
| B.2020年,我国嫦娥五号返回器带回新的月壤样品。月球土壤中含有的橄榄石、辉石、钛铁矿等矿物均是混合物 |
| C.“纷纷灿烂如星陨,霍霍喧逐似火攻。”的灿烂烟花是某些金属的焰色反应,属于化学变化 |
| D.高铁车体用的不锈钢,其硬度和耐腐蚀性均大于纯铁 |
您最近一年使用:0次
2022-01-16更新
|
325次组卷
|
3卷引用:四川省南充高级中学2021-2022学年高一下学期开学考试化学试题
名校
3 . 回答下列问题。
(1)双氧水和84消毒液是生活中常用的两种消毒剂。某同学设计如下实验研究H2O2的性质,已知淀粉遇碘会变蓝,能证明H2O2具有还原性的实验是__________ (填序号)。
(2)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2的(填“>”或“<”);当参加反应的NaClO和H2O2分子的个数比为1∶1时,该反应的还原产物为___________ (填字母序号)。
A.O2 B.H2O C.Cl2 D.NaCl E.NaClO F.NaClO2
(3)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生_________ 反应;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有___________ 性。
(4)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=6CeF3+16NH3↑+12H2O+N2↑,该反应中还原剂是___________ ,请用双线桥法表示反应中电子转移的数目和方向:___________ 。
(5)金属Cu可与硝酸反应,3Cu8HNO33CuNO322NO4H2O;该反应中,硝酸体现了酸性和氧化性,其分子个数比例为___________ 。
(1)双氧水和84消毒液是生活中常用的两种消毒剂。某同学设计如下实验研究H2O2的性质,已知淀粉遇碘会变蓝,能证明H2O2具有还原性的实验是
| 序号 | 实验 | 实验现象 |
| i | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ii | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
A.O2 B.H2O C.Cl2 D.NaCl E.NaClO F.NaClO2
(3)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生
(4)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=6CeF3+16NH3↑+12H2O+N2↑,该反应中还原剂是
(5)金属Cu可与硝酸反应,3Cu8HNO33CuNO322NO4H2O;该反应中,硝酸体现了酸性和氧化性,其分子个数比例为
您最近一年使用:0次
名校
解题方法
4 . 碘化亚铜(CuI)不溶于水和乙醇,可用作有机合成催化剂、树脂改性剂、人工降雨剂、阳极射线管覆盖物等。以斑铜矿(主要成分为Cu3FeS4)为原料制备碘化亚铜的工艺流程如图所示:

回答下列问题:
(1)“酸浸”中,Fe3O4与稀硫酸反应的离子方程式为_______ 。
(2)检验“酸浸”后溶液中是否含Fe2+的试剂是_______ 。
(3)“除杂”操作中加H2O2的目的是_______ 。
(4)红褐色滤渣1为_______ (写化学式)。
(5)滤液2中溶质主要为(NH4)2SO4,检验 的方法是
的方法是_______ 。

回答下列问题:
(1)“酸浸”中,Fe3O4与稀硫酸反应的离子方程式为
(2)检验“酸浸”后溶液中是否含Fe2+的试剂是
(3)“除杂”操作中加H2O2的目的是
(4)红褐色滤渣1为
(5)滤液2中溶质主要为(NH4)2SO4,检验
 的方法是
的方法是
您最近一年使用:0次
名校
5 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
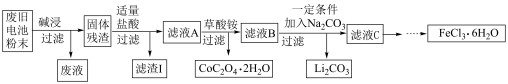
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
257次组卷
|
3卷引用:四川省泸州市泸县第五中学2023-2024学年高一下学期开学化学试题
名校
6 . 习总书记在2021年11月第26次《联合国气候变化框架公约》世界领导人大会上代表中国政府庄严承诺中国在2030年前碳达峰。下列说法正确的是
A.中科院天津化学研究所在世界上首次利用人工方法将 合成淀粉,可以实现利用空气“生产粮食” 合成淀粉,可以实现利用空气“生产粮食” |
| B.以煤为原料的火力发电厂发生的化学反应不包含还原反应 |
| C.天然气不充分燃烧的产物都是酸性氧化物 |
| D.推进煤炭消费替代和转型升级,大力发展新能源不是实现碳达峰的途径之一 |
您最近一年使用:0次
2022-01-25更新
|
350次组卷
|
4卷引用:四川省成都外国语学校2021-2022学年高一下学期入学考试化学试题
名校
解题方法
7 . 亚硝酞氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图I、II、III所示:

图中A导管的作用是___________ 为制备纯净干燥的气体,下表中缺少的药品是:
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→_____ (按气流自左向右方向,用小写字母表示)。
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是______ 。
③装置VII的作用是______________ 。
④装置VIII中吸收尾气时,NOCl发生反应的化学方程式为_________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图I、II、III所示:

图中A导管的作用是
| 装置I | 装置II | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | ① | 浓盐酸 | ② |
| 制备纯净NO | Cu | 稀硝酸 | ③ |

①装置连接顺序为a→
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是
③装置VII的作用是
④装置VIII中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
解题方法
8 . 某学习小组在实验室用二氧化锰和浓盐酸共热制备并收集纯净、干燥的氯气,并进行氯气性质的探究。
(1)仪器a、b的名称是____ 。
(2)以上装置A、B、C、D、E从左到右的连接顺序为____________ 。
(3)如何检查装置A的气密性?____ 。
(4)装置A中发生反应的离子方程式为____ 。
(5)装置B的作用是___ ,有同学觉得此装置不够完善,请你提出改进意见_____ 。
(6)该小组同学设计如图所示装置探究氯气的氧化性。通入氯气时硬质玻璃管中的现象是__ ,原因是__ (用化学方程式解释)。
(7)二氯化硫(S2Cl2)在工业上用于橡胶的硫化。为了在实验室合成S2Cl2,该小组用下图装置将干燥的氯气在110~140℃与硫反应,即可得S2Cl2粗品。写出发生反应的化学方程式为______ 。

(1)仪器a、b的名称是
(2)以上装置A、B、C、D、E从左到右的连接顺序为
(3)如何检查装置A的气密性?
(4)装置A中发生反应的离子方程式为
(5)装置B的作用是
(6)该小组同学设计如图所示装置探究氯气的氧化性。通入氯气时硬质玻璃管中的现象是

(7)二氯化硫(S2Cl2)在工业上用于橡胶的硫化。为了在实验室合成S2Cl2,该小组用下图装置将干燥的氯气在110~140℃与硫反应,即可得S2Cl2粗品。写出发生反应的化学方程式为

您最近一年使用:0次
解题方法
9 . 铁和钙是人类生命活动所必需的元素,利用相关知识,完成下列问题。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是________ (填字母,下同)。
A.Fe B.FeSO4 C.Fe3O4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是__________ 。
A.NaNO2被氧化 B.药品美蓝是还原剂
C.NaNO2是还原剂 D.药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:__________________________________________________ 。
Ⅱ.人体血液里Ca2+的浓度一般采用m g·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
【配制KMnO4标准溶液】如图是配制50 mL KMnO4标准溶液的过程示意图。


(4)请你观察图示判断其中不正确的操作有________ (填序号)。
(5)其中确定50 mL溶液体积的容器是________ (填名称)。
(6)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将________ (填“偏大”或“偏小”)。
【测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗9.00 mL KMnO4溶液。
(7)已知草酸与KMnO4反应的离子方程式为:____________________________________ 。
(8)经过计算,血液样品中Ca2+的浓度为________ mg·cm-3。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是
A.Fe B.FeSO4 C.Fe3O4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
A.NaNO2被氧化 B.药品美蓝是还原剂
C.NaNO2是还原剂 D.药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
Ⅱ.人体血液里Ca2+的浓度一般采用m g·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
【配制KMnO4标准溶液】如图是配制50 mL KMnO4标准溶液的过程示意图。


(4)请你观察图示判断其中不正确的操作有
(5)其中确定50 mL溶液体积的容器是
(6)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将
【测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗9.00 mL KMnO4溶液。
(7)已知草酸与KMnO4反应的离子方程式为:
(8)经过计算,血液样品中Ca2+的浓度为
您最近一年使用:0次
10 . 上海磁悬浮铁路是世界上第一条投入运营的商业磁悬浮铁路。磁悬浮的核心技术是利用超导体的反磁性。以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5mol此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别为( )
| A.0.25、0.50、0.50 | B.0.50、1.00、1.50 |
| C.0.25、1.00、1.50 | D.1.00、0.25、0.17 |
您最近一年使用:0次



