名校
解题方法
1 . 氯化亚铜是一种应用较广的催化剂,易水解,微溶于水,不溶于乙醇。以低品位铜矿砂(主要成分 )为原料制备氯化亚铜的路线如下:
)为原料制备氯化亚铜的路线如下:
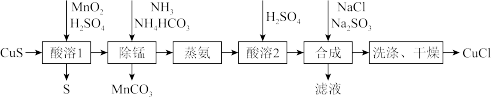
(1)“酸溶1”步骤中发生反应的化学方程式为_______ 。
(2)“除锰”步骤中 转化为
转化为 沉淀,
沉淀, 转变为
转变为 留在溶液中。则“除锰”步骤中发生反应的离子方程式为
留在溶液中。则“除锰”步骤中发生反应的离子方程式为_______ 。
(3)“合成”步骤加入 的速率不宜过快,否则会产生
的速率不宜过快,否则会产生_______ 气体(写化学式),除可能与酸溶时硫酸过量有关,还可能的原因是_______ 。(用离子方程式表示)
(4)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇洗涤除可洗去杂质,减少 的溶解外,还可以
的溶解外,还可以_______ 。
 )为原料制备氯化亚铜的路线如下:
)为原料制备氯化亚铜的路线如下: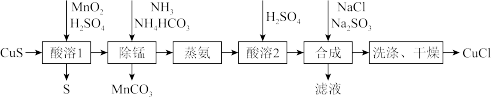
(1)“酸溶1”步骤中发生反应的化学方程式为
(2)“除锰”步骤中
 转化为
转化为 沉淀,
沉淀, 转变为
转变为 留在溶液中。则“除锰”步骤中发生反应的离子方程式为
留在溶液中。则“除锰”步骤中发生反应的离子方程式为(3)“合成”步骤加入
 的速率不宜过快,否则会产生
的速率不宜过快,否则会产生(4)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇洗涤除可洗去杂质,减少
 的溶解外,还可以
的溶解外,还可以
您最近一年使用:0次
2021-04-17更新
|
286次组卷
|
2卷引用:江苏省天一中学2020-2021学年高一下学期期中考试(强化班)化学试题
2 . 2021年9月28日,国务院新闻办公室发表《中国的全面小康》白皮书,宣布中国全面进入小康社会。化学学科正以独特学科价值为全面小康社会保驾护航。
I.屠呦呦制备青蒿素是高效的抗疟药。青蒿素为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点为35℃,乙醚浸取法是从青蒿中提取青蒿素的方法。其主要工艺如图所示:
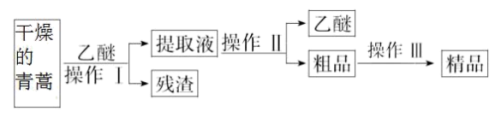
(1)乙醚浸取青蒿时,为增大青蒿素的浸出率,可采取的措施是___________ 。
(2)操作I需要的玻璃仪器主要有烧杯、玻璃棒、_____ ,操作II的名称是_______ 。
(3)操作III的主要过程可能是___________ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
II.我国正努力争取2060年前实现碳中和,用化学手段实现碳中和主要是对 进行捕获收集和资源化利用。
进行捕获收集和资源化利用。
(4)利用低浓度氨水吸收烟气中 生成
生成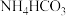 ,其离子方程式为
,其离子方程式为___________ 。
(5)下列说法有利于实现碳中和的是___________ 。
A.积极鼓励植树造林,降低空气中 含量
含量
B.研发利用二氧化碳合成淀粉的人工路线,实现 的资源化利用
的资源化利用
C.开发可燃冰(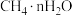 )作为新的替代能源
)作为新的替代能源
I.屠呦呦制备青蒿素是高效的抗疟药。青蒿素为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点为35℃,乙醚浸取法是从青蒿中提取青蒿素的方法。其主要工艺如图所示:

(1)乙醚浸取青蒿时,为增大青蒿素的浸出率,可采取的措施是
(2)操作I需要的玻璃仪器主要有烧杯、玻璃棒、
(3)操作III的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
II.我国正努力争取2060年前实现碳中和,用化学手段实现碳中和主要是对
 进行捕获收集和资源化利用。
进行捕获收集和资源化利用。(4)利用低浓度氨水吸收烟气中
 生成
生成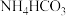 ,其离子方程式为
,其离子方程式为(5)下列说法有利于实现碳中和的是
A.积极鼓励植树造林,降低空气中
 含量
含量B.研发利用二氧化碳合成淀粉的人工路线,实现
 的资源化利用
的资源化利用C.开发可燃冰(
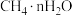 )作为新的替代能源
)作为新的替代能源
您最近一年使用:0次
名校
解题方法
3 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温、常压下合成。
(1)甲组的同学欲制备原料气NO和 ,制备装置如图所示:
,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:

①为了使气体充分反应,从A处进入的气体是_______ (填“ ”或“NO”)。
”或“NO”)。
②装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、 外,另一个作用是
外,另一个作用是_______ 。
④装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为_______ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混合酸,一定条件下混合酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______ 。
(1)甲组的同学欲制备原料气NO和
 ,制备装置如图所示:
,制备装置如图所示:
为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
制备纯净 |  | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |
 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:
①为了使气体充分反应,从A处进入的气体是
 ”或“NO”)。
”或“NO”)。②装置连接顺序为a→
③装置Ⅲ、Ⅳ除可干燥NO、
 外,另一个作用是
外,另一个作用是④装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混合酸,一定条件下混合酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
4 . 甲烷是重要的能源和化工原料,可用于合成氨原料气的制备。
(1)已知1.0 g CH4完全燃烧生成液态水放出55.65 kJ的热量,则CH4燃烧的热化学方程式为___ 。
(2)CH4也可作为第三代固体氧化物燃料电池(SOFC)的燃料,电池结构如图所示。写出该电池负极电极反应式___ 。

(3)H2是合成NH3的原料气。
传统工业用煤炭制H2,原理为:
C+H2O CO+H2,CO+H2O
CO+H2,CO+H2O CO2+H2
CO2+H2
现代工业用CH4制H2,原理为:
CH4+H2O CO+3H2,CO+H2O
CO+3H2,CO+H2O CO2+H2
CO2+H2
与传统工业相比,现代工业制H2的优点有___ 。
(4)制得NH3可应用于制碱。我国化学家侯德邦发明的联合制碱法的主要过程如图所示(部分物质已略去)。

①操作I、II、III中涉及过滤的操作有___ (填操作序号)。
②将NH3和CO2通入饱和食盐水发生反应的化学方程式为___ 。
③针对上述过程,下列说法中正确的是___ (填字母)。
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、 、Cl-
、Cl-
(1)已知1.0 g CH4完全燃烧生成液态水放出55.65 kJ的热量,则CH4燃烧的热化学方程式为
(2)CH4也可作为第三代固体氧化物燃料电池(SOFC)的燃料,电池结构如图所示。写出该电池负极电极反应式

(3)H2是合成NH3的原料气。
传统工业用煤炭制H2,原理为:
C+H2O
 CO+H2,CO+H2O
CO+H2,CO+H2O CO2+H2
CO2+H2现代工业用CH4制H2,原理为:
CH4+H2O
 CO+3H2,CO+H2O
CO+3H2,CO+H2O CO2+H2
CO2+H2与传统工业相比,现代工业制H2的优点有
(4)制得NH3可应用于制碱。我国化学家侯德邦发明的联合制碱法的主要过程如图所示(部分物质已略去)。

①操作I、II、III中涉及过滤的操作有
②将NH3和CO2通入饱和食盐水发生反应的化学方程式为
③针对上述过程,下列说法中正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、
 、Cl-
、Cl-
您最近一年使用:0次
名校
5 . 中国科学院科研团队研究表明,在常温常压和可见光下,基于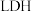 (一种固体催化剂)合成
(一种固体催化剂)合成 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:

(1)从能量转换的角度,该过程将______ 转化成为__________ ;
(2)该反应的化学方程式为:________________ ,氧化剂与还原剂的物质的量之比为__________ ;
(3)关于该反应的说法,正确的是_______
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于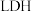 合成
合成 的过程属于人工固氮
的过程属于人工固氮
(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入_________ 至饱和,再通入足量的_________ 可制得 。
。
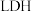 (一种固体催化剂)合成
(一种固体催化剂)合成 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:
(1)从能量转换的角度,该过程将
(2)该反应的化学方程式为:
(3)关于该反应的说法,正确的是
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于
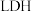 合成
合成 的过程属于人工固氮
的过程属于人工固氮(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入
 。
。
您最近一年使用:0次



