名校
1 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。
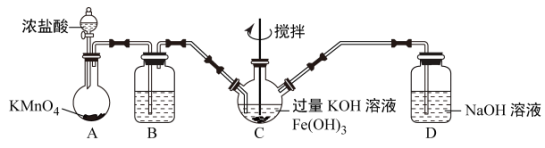
①K2FeO4中铁元素的化合价为___ 价。
②以上装置图中有一处明显的错误请你帮助指出来:___ 。
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式__ 。
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为___ 。
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:___ 。
②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___ 。(用文字描述)
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。

①K2FeO4中铁元素的化合价为
②以上装置图中有一处明显的错误请你帮助指出来:
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO
 +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是
您最近一年使用:0次
2021-09-17更新
|
323次组卷
|
2卷引用:江苏省南京市第二十九中学2020-2021学年高一上学期10月月考化学试卷
名校
解题方法
2 . 如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持仪器已略)。已知:卤素单质的氧化性:Cl2> Br2> I2,如:Cl2+ 2NaBr = Br2+ 2NaCl。
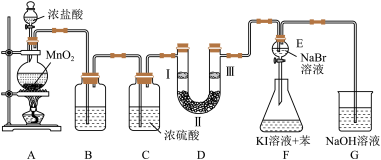
(1)装置B中饱和食盐水的作用是_____ 。
(2)装置D的作用是验证氯气是否具有漂白性,为此D中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是_____ (填字母编号)。
(3)设计装置F的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E中少量溶液加入装置F中,振荡,观察到的现象是_____ ,该现象______ (填“能”或“不能”)说明溴单质的氧化性强于碘单质,原因是_____ 。
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4+ 16HCl(浓)=2KCl + 2MnCl2+ 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目_____ 。
②在该反应中,浓盐酸表现出来的性质是_____ (填氧化性、还原性、酸性或碱性等)。
③上述反应中,有126. 4 g的KMnO4参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙的质量为_____ g;制得的漂白粉应密封保存,原因是_____ 。(用化学方程式表示)

(1)装置B中饱和食盐水的作用是
(2)装置D的作用是验证氯气是否具有漂白性,为此D中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
| c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4+ 16HCl(浓)=2KCl + 2MnCl2+ 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目
②在该反应中,浓盐酸表现出来的性质是
③上述反应中,有126. 4 g的KMnO4参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙的质量为
您最近一年使用:0次
3 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。查阅资料显示:
a. 在一定条件下能被
在一定条件下能被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
b.浓碱条件下, 可被
可被 还原为
还原为 。
。
c. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
d. 为白色沉淀。
为白色沉淀。
实验装置如图(夹持装置略)
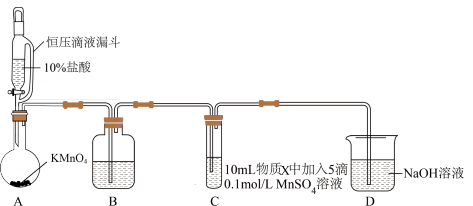
(1)A中发生的反应的化学方程式如下: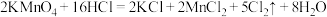 。用双线桥标出该反应中电子转移的方向和数目
。用双线桥标出该反应中电子转移的方向和数目________ 。
(2)通入 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_______ 。
(3)对比实验Ⅰ、Ⅱ通入 后的实验现象,对于
后的实验现象,对于 还原性与溶液酸碱性的认识是
还原性与溶液酸碱性的认识是_______ 。
(4)根据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_______ 。
②取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入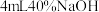 溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为_______ 。同时还可观察到溶液的绿色缓慢加深,即可证明Ⅲ的悬浊液中氧化剂过量。
③从化学反应进行的快慢的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_______ 。
a.
 在一定条件下能被
在一定条件下能被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。b.浓碱条件下,
 可被
可被 还原为
还原为 。
。c.
 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。d.
 为白色沉淀。
为白色沉淀。实验装置如图(夹持装置略)

| 序号 | 物质X | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
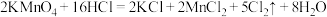 。用双线桥标出该反应中电子转移的方向和数目
。用双线桥标出该反应中电子转移的方向和数目(2)通入
 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为(3)对比实验Ⅰ、Ⅱ通入
 后的实验现象,对于
后的实验现象,对于 还原性与溶液酸碱性的认识是
还原性与溶液酸碱性的认识是(4)根据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入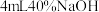 溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为③从化学反应进行的快慢的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2022-11-10更新
|
289次组卷
|
2卷引用:江苏省苏州市2022-2023学年高一上学期期中调研化学试题
解题方法
4 . 氯气是一种重要的化工原料,大量用于制造盐酸、漂白剂、农药、染料和药品等。
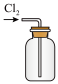
(1)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为 )混合加热,发现了氯气。下图为实验室制取Cl2的装置,请回答:
)混合加热,发现了氯气。下图为实验室制取Cl2的装置,请回答:
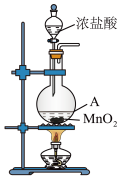
盛放浓盐酸的仪器名称是_______ 。
(2)下图所示制取氯气的净化、收集、尾气处理的装置能达到实验目的的是_______ 。(填序号)
(3)已知:常温下用 和市售浓盐酸(11.9
和市售浓盐酸(11.9 )反应制取Cl2难以进行。但若用漂白粉(有效成分
)反应制取Cl2难以进行。但若用漂白粉(有效成分 )、高锰酸钾等与浓盐酸反应,常温下很容易制取Cl2。
)、高锰酸钾等与浓盐酸反应,常温下很容易制取Cl2。
①已知,如图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式,并用单线桥标明电子转移的方向和数目 :_______ 。

②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是_______ (填序号)。
a.干燥的有色布条 b.湿润的有色布条 c.湿润的淀粉 试纸
试纸
装置C的Ⅱ处的试剂是_______ (填序号)。
a.碱石灰(氢氧化钠和氧化钙的固体混合物) b.无水氯化钙 c.浓硫酸
③装置D中一般不用 澄清石灰水吸收多余的氯气。理由是_______ 。
(4)84消毒液是一种常见的含氯消毒剂,其有效成分为次氯酸钠。
资料:84消毒液中含氯微粒主要有 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;
; 是反映水溶液中所有物质表现出来的氧化—还原性,
是反映水溶液中所有物质表现出来的氧化—还原性, 值越大,氧化性越强。
值越大,氧化性越强。
某兴趣小组同学研究84消毒液的漂白性,实验如下。
I.向2 84消毒液中加入2
84消毒液中加入2 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2 84消毒液中加入2
84消毒液中加入2 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时 随时间的变化曲线如
随时间的变化曲线如图 。
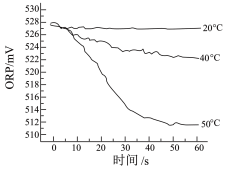
①已知白醋显酸性,不具有漂白性。实验I、Ⅱ现象不同的原因是_______ 。
②由实验Ⅲ可得出的结论是_______ 。
(1)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为
 )混合加热,发现了氯气。下图为实验室制取Cl2的装置,请回答:
)混合加热,发现了氯气。下图为实验室制取Cl2的装置,请回答:
盛放浓盐酸的仪器名称是
(2)下图所示制取氯气的净化、收集、尾气处理的装置能达到实验目的的是
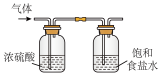 |  |  |
| A.净化Cl2 | B.收集Cl2 | C.尾气处理 |
(3)已知:常温下用
 和市售浓盐酸(11.9
和市售浓盐酸(11.9 )反应制取Cl2难以进行。但若用漂白粉(有效成分
)反应制取Cl2难以进行。但若用漂白粉(有效成分 )、高锰酸钾等与浓盐酸反应,常温下很容易制取Cl2。
)、高锰酸钾等与浓盐酸反应,常温下很容易制取Cl2。①已知,如图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式,并用

②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是
a.干燥的有色布条 b.湿润的有色布条 c.湿润的淀粉
 试纸
试纸装置C的Ⅱ处的试剂是
a.碱石灰(氢氧化钠和氧化钙的固体混合物) b.无水氯化钙 c.浓硫酸
③装置D中一般
(4)84消毒液是一种常见的含氯消毒剂,其有效成分为次氯酸钠。
资料:84消毒液中含氯微粒主要有
 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;
; 是反映水溶液中所有物质表现出来的氧化—还原性,
是反映水溶液中所有物质表现出来的氧化—还原性, 值越大,氧化性越强。
值越大,氧化性越强。某兴趣小组同学研究84消毒液的漂白性,实验如下。
I.向2
 84消毒液中加入2
84消毒液中加入2 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。Ⅱ.向2
 84消毒液中加入2
84消毒液中加入2 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。Ⅲ.测得84消毒液在不同温度时
 随时间的变化曲线如
随时间的变化曲线如
①已知白醋显酸性,不具有漂白性。实验I、Ⅱ现象不同的原因是
②由实验Ⅲ可得出的结论是
您最近一年使用:0次
5 . 84消毒液是一种常见的含氯消毒剂。如图为某品牌84消毒液的说明书中的部分内容。

产品特点
本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。
注意事项
①本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。
②不得将本品与酸性产品(如洁厕类清洁产品)同时使用。
③置于避光、阴凉处保存。
④需稀释后使用, 勿口服。
(1)84消毒液的主要成分为___________ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:___________ 。
(3)某同学研究 84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于 ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性, ORP值越大, 氧化性越强。
I.向 2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向 2mL84消毒液中加入2mL白醋后, 放入红色纸片, 观察到纸片迅速褪色。
Ⅲ.测得 84消毒液在不同温度时ORP随时间的变化曲线如下。
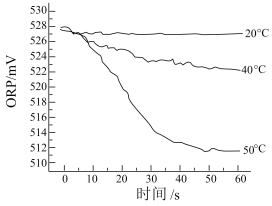
①已知白醋显酸性,且酸性强于次氯酸,不具有漂白性。实验I、Ⅱ现象不同的原因是___________ 。
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是___________ 。
③由实验Ⅲ可得出的结论是___________ 。ORP 值不同的原因可能是___________ 。
(4)某同学将纯净的 Cl2通入一定量石灰乳中来制取漂白粉。
①若通入x个 Cl2全反应,则反应过程中转移电子___________ 个。
②漂白粉的主要成分是___________ 。

产品特点
本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。
注意事项
①本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。
②不得将本品与酸性产品(如洁厕类清洁产品)同时使用。
③置于避光、阴凉处保存。
④需稀释后使用, 勿口服。
(1)84消毒液的主要成分为
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究 84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于 ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性, ORP值越大, 氧化性越强。
I.向 2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向 2mL84消毒液中加入2mL白醋后, 放入红色纸片, 观察到纸片迅速褪色。
Ⅲ.测得 84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,且酸性强于次氯酸,不具有漂白性。实验I、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
(4)某同学将纯净的 Cl2通入一定量石灰乳中来制取漂白粉。
①若通入x个 Cl2全反应,则反应过程中转移电子
②漂白粉的主要成分是
您最近一年使用:0次
6 . 氯气是一种重要的化工原料,大量用于制造盐酸、漂白剂、农药、染料和药品等。
(1)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为 )混合加热,发现了氯气。下图为实验室制取
)混合加热,发现了氯气。下图为实验室制取 的装置,请回答:
的装置,请回答:

盛放浓盐酸的仪器名称是_____ 。
(2)上图所示制取氯气的净化、收集、尾气处理的装置能 达到实验目的的是_____ 。(填序号)
(3)已知:常温下用 和市售浓盐酸
和市售浓盐酸 反应制取
反应制取 难以进行。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取
难以进行。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取 。
。

①已知,如图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式,并用单线桥标明电子转移的方向和数目:_____ 。
②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是_____ (填“干燥的有色布条”或“湿润的有色布条)。装置C的Ⅱ处的试剂是_____ (填序号)
a.碱石灰(氢氧化钠和氧化钙的固体混合物) b.无水氯化钙 c.浓硫酸
③装置D中一般不用 澄清石灰水吸收多余的氯气。理由是_____ 。
(4)84消毒液是一种常见的含氯消毒剂,其有效成分为次氯酸钠。
资料:84消毒液中含氯微粒主要有 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;
;
ORP是反映水溶液中所有物质表现出来的氧化一还原性,ORP值越大,氧化性越强。
某兴趣小组同学研究84消毒液的漂白性,实验如下。
Ⅰ.向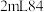 消毒液中加入
消毒液中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向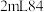 消毒液中加入
消毒液中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如图。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_____ 。
②由实验Ⅲ可得出的结论是_____ 。
③针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠 的84消毒液
的84消毒液 ,加水稀释至
,加水稀释至 ,则稀释后的溶液中次氯酸钠的物质的量浓度为
,则稀释后的溶液中次氯酸钠的物质的量浓度为_____  。
。
(1)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为
 )混合加热,发现了氯气。下图为实验室制取
)混合加热,发现了氯气。下图为实验室制取 的装置,请回答:
的装置,请回答:
盛放浓盐酸的仪器名称是
(2)上图所示制取氯气的净化、收集、尾气处理的装置
(3)已知:常温下用
 和市售浓盐酸
和市售浓盐酸 反应制取
反应制取 难以进行。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取
难以进行。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取 。
。
①已知,如图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式,并用单线桥标明电子转移的方向和数目:
②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是
a.碱石灰(氢氧化钠和氧化钙的固体混合物) b.无水氯化钙 c.浓硫酸
③装置D中一般
(4)84消毒液是一种常见的含氯消毒剂,其有效成分为次氯酸钠。
资料:84消毒液中含氯微粒主要有
 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;
;ORP是反映水溶液中所有物质表现出来的氧化一还原性,ORP值越大,氧化性越强。
某兴趣小组同学研究84消毒液的漂白性,实验如下。
Ⅰ.向
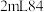 消毒液中加入
消毒液中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。Ⅱ.向
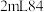 消毒液中加入
消毒液中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如图。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②由实验Ⅲ可得出的结论是
③针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠
 的84消毒液
的84消毒液 ,加水稀释至
,加水稀释至 ,则稀释后的溶液中次氯酸钠的物质的量浓度为
,则稀释后的溶液中次氯酸钠的物质的量浓度为 。
。
您最近一年使用:0次
7 . 84消毒液是一种常见的含氯消毒剂。如图1为某品牌84消毒液的说明书中的部分内容。

(1)84消毒液的主要成分为 _______ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO﹣、Cl﹣、HClO;相同浓度时,HClO的氧化性强于ClO﹣;ORP是反映水溶液中所有物质表现出来的氧化﹣还原性,ORP值越大,氧化性越强。
Ⅰ.将2mL84消毒液中加2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如图2。
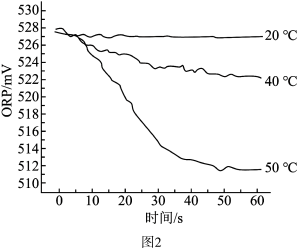
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______ 。
②实验表明,向84消毒液中加入较多硫酸时会产生氯气,生成氯气的离子方程式是_______ 。
③由实验Ⅲ可得出的结论是_______ 。ORP值不同的原因可能是 _______ 。

| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 (1)本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 (2)不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 (3)置于避光、阴凉处保存。 (4)需稀释后使用,勿口服。 |
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO﹣、Cl﹣、HClO;相同浓度时,HClO的氧化性强于ClO﹣;ORP是反映水溶液中所有物质表现出来的氧化﹣还原性,ORP值越大,氧化性越强。
Ⅰ.将2mL84消毒液中加2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如图2。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
您最近一年使用:0次
2022-12-05更新
|
173次组卷
|
2卷引用:江苏省南京市六校联合体2023-2024学年高一上学期期中联合调研化学试题
名校
8 . 高铁酸钾 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
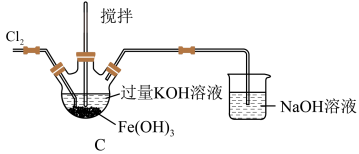
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为___________ (并用双线桥表示电子转移),C中 发生的反应还有
发生的反应还有___________ 。(用离子方程式表示)
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:
方案一:取少量a,经测定含有
方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。
①由方案一中可知a中含有 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(文字描述)。
②方案二中要用KOH溶液充分洗涤所得固体的原因是___________ 。
③根据 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是___________ 。
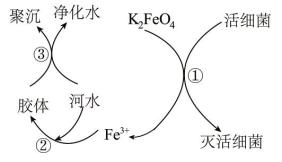
(3)高铁酸钾水处理原理如图所示。
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号);过程③属于___________ (填“物理”或“化学”)变化。
②根据上述原理分析,作水处理剂时, 的作用有
的作用有___________ 。(填两个)
 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为
 发生的反应还有
发生的反应还有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:方案一:取少量a,经测定含有

方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将
 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。①由方案一中可知a中含有
 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由②方案二中要用KOH溶液充分洗涤所得固体的原因是
③根据
 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是(3)高铁酸钾水处理原理如图所示。

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了
②根据上述原理分析,作水处理剂时,
 的作用有
的作用有
您最近一年使用:0次
名校
解题方法
9 . 84消毒液是一种常见的含氯消毒剂。如图为某品牌84消毒液的说明书中的部分内容。

(1)84消毒液的主要成分为_______ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
Ⅰ.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
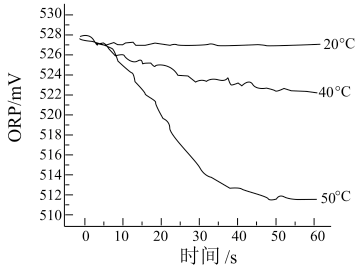
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______ 。
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是_______ 。
③由实验Ⅲ可得出的结论是_______ 。ORP值不同的原因可能是_______ 。
(4)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_______ mol∙L−1。

| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 4.需稀释后使用,勿口服。 |
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
Ⅰ.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多稀硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
(4)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次
2021-01-24更新
|
572次组卷
|
4卷引用:江苏省泰州中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
10 . 铁是最常见的金属之一、纳米铁粉可用于处理酸性含氮废水(主要含 );铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与
);铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与 进行浸泡,在表面形成
进行浸泡,在表面形成 的同时有
的同时有 生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下,
生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下, 的氧化性强于
的氧化性强于 ,
, 的盐与碱反应可以转化为不溶性的
的盐与碱反应可以转化为不溶性的 。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成
。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成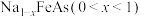 的同时释放出
的同时释放出 。下列说法正确的是
。下列说法正确的是
 );铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与
);铁易被腐蚀,经碱性发蓝处理可增强其抗腐蚀性,方法为:用NaOH与 进行浸泡,在表面形成
进行浸泡,在表面形成 的同时有
的同时有 生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下,
生成;铁与砷反应得到的FeAs可被Na还原得到NaFeAs,NaFeAs难溶于水,是一种超导材料。镍(Ni)与Fe单质化学性质相似,金属活动性比铁略低。酸性条件下, 的氧化性强于
的氧化性强于 ,
, 的盐与碱反应可以转化为不溶性的
的盐与碱反应可以转化为不溶性的 。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成
。在隔绝空气条件下,将NaFeAs加入水中,NaFeAs转化成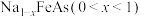 的同时释放出
的同时释放出 。下列说法正确的是
。下列说法正确的是| A.NaFeAs与水反应所得溶液pH下降 | B.消耗1 mol NaFeAs,转移2 mol电子 |
| C.NaFeAs与水反应时体现还原性 | D.制备NaFeAs无须隔绝空气和水 |
您最近一年使用:0次
2024-04-13更新
|
72次组卷
|
2卷引用:江苏省盐城市大丰高级中学2023-2024学年高一下学期(创新班)第一次阶段性考试化学试卷



