名校
1 .  、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用 可合成多种化工产品。
可合成多种化工产品。
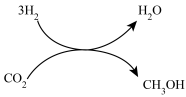
2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为___________ 。
②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为___________ 。过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇( )实现
)实现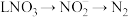 的转化,将
的转化,将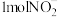 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为___________ 。
(3)硫酸生产及煤燃烧过程中产生的废气 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于___________ (填“电解质”或“非电解质”),氨水吸收少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
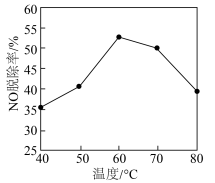
(4)氮的氧化物(NO、 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________ 。
 、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用
 可合成多种化工产品。
可合成多种化工产品。2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现
 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为 )实现
)实现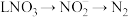 的转化,将
的转化,将 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为(3)硫酸生产及煤燃烧过程中产生的废气
 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于 ,反应的离子方程式为
,反应的离子方程式为(4)氮的氧化物(NO、
 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
您最近一年使用:0次
2 . 2021年9月28日,国务院新闻办公室发表《中国的全面小康》白皮书,宣布中国全面进入小康社会。化学学科正以独特学科价值为全面小康社会保驾护航。
I.屠呦呦制备青蒿素是高效的抗疟药。青蒿素为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点为35℃,乙醚浸取法是从青蒿中提取青蒿素的方法。其主要工艺如图所示:
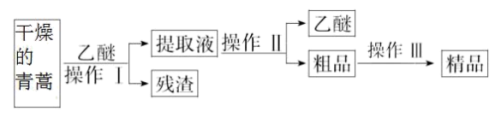
(1)乙醚浸取青蒿时,为增大青蒿素的浸出率,可采取的措施是___________ 。
(2)操作I需要的玻璃仪器主要有烧杯、玻璃棒、_____ ,操作II的名称是_______ 。
(3)操作III的主要过程可能是___________ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
II.我国正努力争取2060年前实现碳中和,用化学手段实现碳中和主要是对 进行捕获收集和资源化利用。
进行捕获收集和资源化利用。
(4)利用低浓度氨水吸收烟气中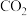 生成
生成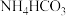 ,其离子方程式为
,其离子方程式为___________ 。
(5)下列说法有利于实现碳中和的是___________ 。
A.积极鼓励植树造林,降低空气中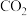 含量
含量
B.研发利用二氧化碳合成淀粉的人工路线,实现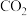 的资源化利用
的资源化利用
C.开发可燃冰(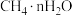 )作为新的替代能源
)作为新的替代能源
I.屠呦呦制备青蒿素是高效的抗疟药。青蒿素为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点为35℃,乙醚浸取法是从青蒿中提取青蒿素的方法。其主要工艺如图所示:

(1)乙醚浸取青蒿时,为增大青蒿素的浸出率,可采取的措施是
(2)操作I需要的玻璃仪器主要有烧杯、玻璃棒、
(3)操作III的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
II.我国正努力争取2060年前实现碳中和,用化学手段实现碳中和主要是对
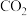 进行捕获收集和资源化利用。
进行捕获收集和资源化利用。(4)利用低浓度氨水吸收烟气中
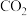 生成
生成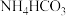 ,其离子方程式为
,其离子方程式为(5)下列说法有利于实现碳中和的是
A.积极鼓励植树造林,降低空气中
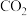 含量
含量B.研发利用二氧化碳合成淀粉的人工路线,实现
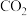 的资源化利用
的资源化利用C.开发可燃冰(
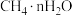 )作为新的替代能源
)作为新的替代能源
您最近一年使用:0次
名校
3 .  、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用 可合成多种化工产品。
可合成多种化工产品。
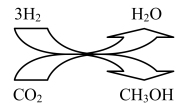
① 与
与 能在催化剂表面反应生成优质气体燃料
能在催化剂表面反应生成优质气体燃料 和
和 ,该反应的化学方程式为
,该反应的化学方程式为__ 。
②2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于___________ (填“电解质”或“非电解质”),标准状况下,1体积水约能溶解 体积
体积 ,所得氨水密度为
,所得氨水密度为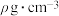 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为___________ 。
②氨水吸收少量 ,可生成
,可生成 ,反应的离子方程式为
,反应的离子方程式为___________ 。所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为___________ 。
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。
可合成多种化工产品。
①
 与
与 能在催化剂表面反应生成优质气体燃料
能在催化剂表面反应生成优质气体燃料 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于 体积
体积 ,所得氨水密度为
,所得氨水密度为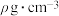 ,则该氨水的物质的量浓度为
,则该氨水的物质的量浓度为②氨水吸收少量
 ,可生成
,可生成 ,反应的离子方程式为
,反应的离子方程式为 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 完成下列有关物质的量的相关计算
(1)___________ 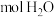 中含有的氧原子数与
中含有的氧原子数与 中含有的氧原子数相等。
中含有的氧原子数相等。
(2)等质量的 和
和 ,分子个数比为
,分子个数比为___________ ;等物质的量的 和
和 ,质子数之比为
,质子数之比为___________ ;含原子数目相等的 和
和 ,在相同条件下的体积比
,在相同条件下的体积比___________ 。
(3)臭氧是地球生命的保护伞。实验室可将氧气通过高压放电管来制取臭氧: 。
。
①若在上述反应中有30%的氧气转化为臭氧,所得混合气体的平均摩尔质量为___________ (保留一位小数)。
②将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为___________ L。
③实验室将氧气和臭氧的混合气体896mL (标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气态全部参加反应),粉末质量变为21.6g,则原混合气体中臭氧的体积分数为___________ 。
(4)我国自主研制成功的第一台低温超导除铁器,2008年11月2日在北京通过了技术鉴定。以Y2O3、BaCO3和CuO为原料,经研磨烧结可结合成一种超导物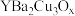 。欲合成0.5 mol此超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是
。欲合成0.5 mol此超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是___________ 、___________ 、___________ 。
(1)
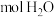 中含有的氧原子数与
中含有的氧原子数与 中含有的氧原子数相等。
中含有的氧原子数相等。(2)等质量的
 和
和 ,分子个数比为
,分子个数比为 和
和 ,质子数之比为
,质子数之比为 和
和 ,在相同条件下的体积比
,在相同条件下的体积比(3)臭氧是地球生命的保护伞。实验室可将氧气通过高压放电管来制取臭氧:
 。
。①若在上述反应中有30%的氧气转化为臭氧,所得混合气体的平均摩尔质量为
②将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为
③实验室将氧气和臭氧的混合气体896mL (标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气态全部参加反应),粉末质量变为21.6g,则原混合气体中臭氧的体积分数为
(4)我国自主研制成功的第一台低温超导除铁器,2008年11月2日在北京通过了技术鉴定。以Y2O3、BaCO3和CuO为原料,经研磨烧结可结合成一种超导物
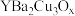 。欲合成0.5 mol此超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是
。欲合成0.5 mol此超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是
您最近一年使用:0次
名校
5 . 硫及其化合物应用广泛,同时也会对环境造成污染。
(1)硫被用来制造黑色火药、火柴等,也是生产橡胶制品的重要原料。有一种硫单质Sx,该单质蒸气对氢气的相对密度为128,则x=___________ 。
(2)H2S有剧毒,可用作有机合成还原剂、农药、医药、催化剂的再生等。一种脱硫技术如下:第一步,用Na2CO3溶液吸收H2S:H2S+Na2CO3=NaHS+NaHCO3;第二步,用NaVO3溶液与NaHS反应生成硫单质,同时还产生Na2V4O9.Na2V4O9中V的平均化合价为___________ ,第二步反应的离子方程式为___________ 。
(3)SO2尾气先用氨水吸收生成(NH4)2SO3, 再被氧化成
再被氧化成 ,最终得到副产物氮肥,变废为宝。两种氧化方案如下:
,最终得到副产物氮肥,变废为宝。两种氧化方案如下:
方案l:2 +O2=2
+O2=2 。
。
方案2:2[Co(NH3)6]2++O2=[(NH3)5Co-O-O-Co(NH3)5]4++2NH3, +H2O+2NH3+[(NH3)5Co-O-O-Co(NH3)5]4+⇌
+H2O+2NH3+[(NH3)5Co-O-O-Co(NH3)5]4+⇌ +2[Co(NH3)6]3++2OH-。
+2[Co(NH3)6]3++2OH-。
①氨水中存在的分子有___________ (填化学式)。
②通过实验可知,[(NH3)5Co-O-O-Co(NH3)5]4+将 氧化为
氧化为 的能力大于O2,可能的原因是
的能力大于O2,可能的原因是___________ 。
(4)连二亚硫酸钠(Na2S2O4)适合作木浆造纸的漂白剂。实验室制法:将甲酸和溶于甲醇和水混合溶剂的NaOH混合反应后,再通入SO2气体即可制得连二亚硫酸钠,同时生成能使澄清石灰水变浑浊的气体,则该制备反应的化学方程式为___________ 。
(1)硫被用来制造黑色火药、火柴等,也是生产橡胶制品的重要原料。有一种硫单质Sx,该单质蒸气对氢气的相对密度为128,则x=
(2)H2S有剧毒,可用作有机合成还原剂、农药、医药、催化剂的再生等。一种脱硫技术如下:第一步,用Na2CO3溶液吸收H2S:H2S+Na2CO3=NaHS+NaHCO3;第二步,用NaVO3溶液与NaHS反应生成硫单质,同时还产生Na2V4O9.Na2V4O9中V的平均化合价为
(3)SO2尾气先用氨水吸收生成(NH4)2SO3,
 再被氧化成
再被氧化成 ,最终得到副产物氮肥,变废为宝。两种氧化方案如下:
,最终得到副产物氮肥,变废为宝。两种氧化方案如下:方案l:2
 +O2=2
+O2=2 。
。方案2:2[Co(NH3)6]2++O2=[(NH3)5Co-O-O-Co(NH3)5]4++2NH3,
 +H2O+2NH3+[(NH3)5Co-O-O-Co(NH3)5]4+⇌
+H2O+2NH3+[(NH3)5Co-O-O-Co(NH3)5]4+⇌ +2[Co(NH3)6]3++2OH-。
+2[Co(NH3)6]3++2OH-。①氨水中存在的分子有
②通过实验可知,[(NH3)5Co-O-O-Co(NH3)5]4+将
 氧化为
氧化为 的能力大于O2,可能的原因是
的能力大于O2,可能的原因是(4)连二亚硫酸钠(Na2S2O4)适合作木浆造纸的漂白剂。实验室制法:将甲酸和溶于甲醇和水混合溶剂的NaOH混合反应后,再通入SO2气体即可制得连二亚硫酸钠,同时生成能使澄清石灰水变浑浊的气体,则该制备反应的化学方程式为
您最近一年使用:0次
2021-10-13更新
|
698次组卷
|
3卷引用:江苏省苏州实验中学2021-2022学年第高一上学期12月月考调研化学试题
名校
6 . 中国科学院科研团队研究表明,在常温常压和可见光下,基于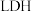 (一种固体催化剂)合成
(一种固体催化剂)合成 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:

(1)从能量转换的角度,该过程将______ 转化成为__________ ;
(2)该反应的化学方程式为:________________ ,氧化剂与还原剂的物质的量之比为__________ ;
(3)关于该反应的说法,正确的是_______
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于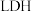 合成
合成 的过程属于人工固氮
的过程属于人工固氮
(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入_________ 至饱和,再通入足量的_________ 可制得 。
。
 (一种固体催化剂)合成
(一种固体催化剂)合成 的原理示意图如下。试回答下列问题:
的原理示意图如下。试回答下列问题:
(1)从能量转换的角度,该过程将
(2)该反应的化学方程式为:
(3)关于该反应的说法,正确的是
A.催化剂能增大化学反应速率,缩短反应时间,从而提高产氨效率
B.该反应过程中涉及极性键和非极性键的断裂和形成
C.可以通过分离液态空气的方法获得氮气
D.基于
 合成
合成 的过程属于人工固氮
的过程属于人工固氮(4)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。加入原料的顺序是:在氯化钠溶液,通入
 。
。
您最近一年使用:0次



