名校
解题方法
1 . 央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知 中铬元素是+3价,则其中铁元素是
中铬元素是+3价,则其中铁元素是__________ 价。 是一种酸根离子,则
是一种酸根离子,则 属于
属于__________ (填“酸”、“碱”、“盐”或“氧化物”)。
(2)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的__________ (填序号)。
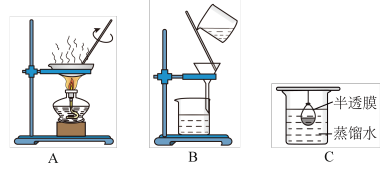
(3)现有10mL明胶的水溶液与5mLK2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明 能够透过半透膜:
能够透过半透膜:_____________________ ;该检验过程中发生的离子方程式为____________________ 。
(1)已知
 中铬元素是+3价,则其中铁元素是
中铬元素是+3价,则其中铁元素是 是一种酸根离子,则
是一种酸根离子,则 属于
属于(2)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的

(3)现有10mL明胶的水溶液与5mLK2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
 能够透过半透膜:
能够透过半透膜:
您最近一年使用:0次
名校
解题方法
2 . 现有16.0gCO和CO2的混合气体,在标准状况下其体积为8.96L。请回答下列问题:
(1)该混合气体的平均摩尔质量为_____ 。
(2)混合气体中碳原子的个数为____ (用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。

①气球中收集到的气体的摩尔质量为____ 。
②气球中收集到的气体中,电子总数为____ (用NA表示阿伏加德罗常数的值,假设气体全部进入气球中)。
(1)该混合气体的平均摩尔质量为
(2)混合气体中碳原子的个数为
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。

①气球中收集到的气体的摩尔质量为
②气球中收集到的气体中,电子总数为
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)从1L 溶液中取出100mL,向其中加入200mL
溶液中取出100mL,向其中加入200mL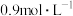 的
的 溶液恰好使
溶液恰好使 完全沉淀,则原溶液中
完全沉淀,则原溶液中 的物质的量浓度为
的物质的量浓度为_______ 。
(2)12.4g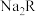 含0.4mo
含0.4mo ,则
,则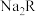 的摩尔质量为
的摩尔质量为_______ 。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是_______ 。
(4)标况下,1体积水中溶解了V体积HCl气体,所得溶液的密度为 ,所得溶液的物质的量浓度为
,所得溶液的物质的量浓度为_______ 。
(1)从1L
 溶液中取出100mL,向其中加入200mL
溶液中取出100mL,向其中加入200mL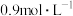 的
的 溶液恰好使
溶液恰好使 完全沉淀,则原溶液中
完全沉淀,则原溶液中 的物质的量浓度为
的物质的量浓度为(2)12.4g
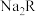 含0.4mo
含0.4mo ,则
,则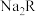 的摩尔质量为
的摩尔质量为(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是
(4)标况下,1体积水中溶解了V体积HCl气体,所得溶液的密度为
 ,所得溶液的物质的量浓度为
,所得溶液的物质的量浓度为
您最近一年使用:0次
名校
解题方法
4 . 某兴趣小组同学向一定体积的 溶液中逐滴滴加稀
溶液中逐滴滴加稀 ,不断搅拌并测定溶液导电能力的变化(装置如图所示)。
,不断搅拌并测定溶液导电能力的变化(装置如图所示)。

I.实验测得混合溶液的导电能力随时间变化的曲线如图所示。

(1)写出 溶液与稀硫酸反应的离子方程式
溶液与稀硫酸反应的离子方程式_______ 。
(2)该小组的同学关于如图的说法中正确的是_______ (填“序号”)。
①AB段溶液的导电能力不断减弱,说明生成的 不是电解质
不是电解质
②B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
③BC段溶液的导电能力不断增大,主要是由于过量的 ,电离出的离子导电
,电离出的离子导电
④a时刻 溶液与稀H2SO4恰好中和
溶液与稀H2SO4恰好中和
Ⅱ.配制250mL 1.0mol/L 溶液。
溶液。
(3)计算:需要用量筒量取18mol/L 溶液
溶液_______ mL。
(4)下列操作将导致所配制的 溶液浓度偏大有
溶液浓度偏大有_______ 。
a.移液过程有 溶液溅出瓶外
溶液溅出瓶外
b.将量取浓硫酸的量筒洗涤干净,洗涤液也转移到容量瓶中
c.定容时俯视容量瓶刻度线
d.加水超过刻度线,用胶头滴管吸出多余液体
(5)现有浓度为18mol/L的浓硫酸溶液200g,需要加入一定量的水将其稀释为9mol/L,则加入水的体积是_______ 。
A.大于200mL B.小于200mL C.等于200mL
 溶液中逐滴滴加稀
溶液中逐滴滴加稀 ,不断搅拌并测定溶液导电能力的变化(装置如图所示)。
,不断搅拌并测定溶液导电能力的变化(装置如图所示)。
I.实验测得混合溶液的导电能力随时间变化的曲线如图所示。

(1)写出
 溶液与稀硫酸反应的离子方程式
溶液与稀硫酸反应的离子方程式(2)该小组的同学关于如图的说法中正确的是
①AB段溶液的导电能力不断减弱,说明生成的
 不是电解质
不是电解质②B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
③BC段溶液的导电能力不断增大,主要是由于过量的
 ,电离出的离子导电
,电离出的离子导电④a时刻
 溶液与稀H2SO4恰好中和
溶液与稀H2SO4恰好中和Ⅱ.配制250mL 1.0mol/L
 溶液。
溶液。(3)计算:需要用量筒量取18mol/L
 溶液
溶液(4)下列操作将导致所配制的
 溶液浓度偏大有
溶液浓度偏大有a.移液过程有
 溶液溅出瓶外
溶液溅出瓶外b.将量取浓硫酸的量筒洗涤干净,洗涤液也转移到容量瓶中
c.定容时俯视容量瓶刻度线
d.加水超过刻度线,用胶头滴管吸出多余液体
(5)现有浓度为18mol/L的浓硫酸溶液200g,需要加入一定量的水将其稀释为9mol/L,则加入水的体积是
A.大于200mL B.小于200mL C.等于200mL
您最近一年使用:0次
名校
5 . 下表为元素周期表的一部分,请回答下列有关问题
(1)已知元素⑩的一种核素,其中子数为45,用原子符号表示该核素为___________ 。
(2)由元素②和④形成的三核分子的结构式为___________ ,①和②形成的简单氢化物的空间结构是___________ ,元素③所形成的单质的电子式为___________ 。用电子式描述⑨⑦形成的A2B型化合物的形成过程___________ 。
(3)由上述元素构成的淡黄色固体化合物的电子式为___________ ,该化合物所含的化学键类型为___________ (填“离子键”、“极性键”或“非极性键”)。
(4)元素②③⑦⑧的最高价氧化物对应水化物的酸性由强到弱的顺序是___________ ,元素⑨的最高价氧化物对应水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5)元素的非金属性⑧_____ ⑩(填“>”或“<”);下列事实不能证明上述结论的是_____ 。
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
(6)某同学利用如图装置来验证同主族元素非金属性的变化规律。

①仪器A的名称为___________ ,干燥管D的作用为___________
② 若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加入碘化钾和苯的混合溶液,观察到C中溶液出现的现象是___________ ,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,吸收尾气的离子方程式为___________ 。
③若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液出现的现象是___________ ,即可证明。但有的同学认为,应在两装置间添加装有___________ 溶液的洗气瓶才更准确,用这套装置同时可以证明非金属性,Cl>C>Si,需改动的部分是___________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)由元素②和④形成的三核分子的结构式为
(3)由上述元素构成的淡黄色固体化合物的电子式为
(4)元素②③⑦⑧的最高价氧化物对应水化物的酸性由强到弱的顺序是
(5)元素的非金属性⑧
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
(6)某同学利用如图装置来验证同主族元素非金属性的变化规律。

①仪器A的名称为
② 若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加入碘化钾和苯的混合溶液,观察到C中溶液出现的现象是
③若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液出现的现象是
您最近一年使用:0次
6 . 将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为___________ 。
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论___________ 。
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为___________ 。
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为___________ 。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子移向___________ 极;(填“阴极”或“阳极”)
(5)可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若___________ (填实验现象),则说明该Fe(OH)3胶体中的杂质离子已经完全除去。

甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子移向
(5)可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若

您最近一年使用:0次
2021-09-14更新
|
816次组卷
|
5卷引用:江西省宜春市上高二中2022-2023学年高一上学期第一次月考化学试题
江西省宜春市上高二中2022-2023学年高一上学期第一次月考化学试题 (已下线)衔接点04 分散系 胶体-2022年初升高化学无忧衔接河南省林州市第一中学2021-2022学年高一上学期开学检测(实验班)化学试题(已下线)2.1.2 胶体-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)(已下线)期中测试卷03-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)
7 . 氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O。若有0.8mol还原剂被氧化,则转移的电子数是________ 。
(2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为____ ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式__________ 。
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为__________ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为_________ 。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O。若有0.8mol还原剂被氧化,则转移的电子数是
(2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为
您最近一年使用:0次
2021-03-06更新
|
68次组卷
|
2卷引用:江西省抚州市金溪县第一中学2021-2022学年高二下学期开学考试化学试题
8 . 某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:
(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____ (填序号)。
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为__________________ 。
(3)反应②的化学方程式为___________ 。
(4)反应③发生时观察到的现象是__________ ,用化学方程式表示颜色变化的原因________ 。

(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为
(3)反应②的化学方程式为
(4)反应③发生时观察到的现象是
您最近一年使用:0次
2021-03-04更新
|
186次组卷
|
3卷引用:江西省抚州市金溪县第一中学2021-2022学年高二下学期开学考试化学试题
江西省抚州市金溪县第一中学2021-2022学年高二下学期开学考试化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期入学考试化学试题(已下线)第09练 铁及其化合物-2022年【寒假分层作业】高一化学(人教版2019)
名校
9 . Ⅰ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有________ (填字母)。
A 烧杯 B 500 mL容量瓶 C 漏斗 D 胶头滴管 E 玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为________ g。
(3)下列主要操作步骤的正确顺序是________ (填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500 mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度_______ (填“偏高、偏低”或“不变”)。
Ⅱ.如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______ 。
A 溶液中HCl的物质的量 B 溶液的浓度
C 溶液中Cl-的数目 D 溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取______ mL上述浓盐酸进行配制。
Ⅲ.现有0.27kg质量分数为10%的CuCl2溶液,则溶液中CuCl2的物质的量为___________
(1)配制过程中不需要使用的化学仪器有
A 烧杯 B 500 mL容量瓶 C 漏斗 D 胶头滴管 E 玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为
(3)下列主要操作步骤的正确顺序是
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500 mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度
Ⅱ.如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g/cm3 HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
A 溶液中HCl的物质的量 B 溶液的浓度
C 溶液中Cl-的数目 D 溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取
Ⅲ.现有0.27kg质量分数为10%的CuCl2溶液,则溶液中CuCl2的物质的量为
您最近一年使用:0次
2019-11-27更新
|
1001次组卷
|
6卷引用:江西省南昌市八一中学2021-2022学年高二下学期化学期末考试试题
江西省南昌市八一中学2021-2022学年高二下学期化学期末考试试题河南省洛阳市宜阳县第一高级中学2022-2023学年高一上学期第四次能力达标测试化学试题黑龙江省绥化市青冈县第一中学2019-2020学年高一上学期期中考试(B班)化学试题河北省邯郸市魏县2021-2022学年高一上学期11月联考化学试题江苏省南京市第五高级中学2022-2023学年高一上学期学情自测卷化学试题(已下线)押题卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)



