解题方法
1 . 将5.60 g纯铁粉加入适量稀硫酸中,固体完全溶解。加热条件下向反应液中先加入1.7 g NaNO3固体(已知NO3-在酸性条件下具有强氧化性),再通入448 mL Cl2(标准状况下,假设Cl2不逸出),产物中铁元素全部以Fe3+存在。(要求简要写出计算过程)
(1)被氯气氧化的Fe2+物质的量为________ 。
(2)NaNO3对应的还原产物中氮元素的化合价是________ 。
(1)被氯气氧化的Fe2+物质的量为
(2)NaNO3对应的还原产物中氮元素的化合价是
您最近一年使用:0次
2 . 常温下 为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。
为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。 可通过如下反应制备:
可通过如下反应制备: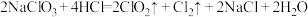 。现往足量
。现往足量 中通入
中通入 (标准状况下)气体制
(标准状况下)气体制 ,请计算:
,请计算:
(1)通入的HCl气体物质的量为___________ mol。
(2)充分反应后,转移电子数目为___________ 个。
(3)若将生成的混合气体通过装有亚氯酸钠( )的干燥管,可吸收
)的干燥管,可吸收 并生成
并生成 。通过两步制备共产生
。通过两步制备共产生 质量为
质量为___________ g。
 为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。
为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。 可通过如下反应制备:
可通过如下反应制备: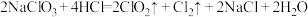 。现往足量
。现往足量 中通入
中通入 (标准状况下)气体制
(标准状况下)气体制 ,请计算:
,请计算:(1)通入的HCl气体物质的量为
(2)充分反应后,转移电子数目为
(3)若将生成的混合气体通过装有亚氯酸钠(
 )的干燥管,可吸收
)的干燥管,可吸收 并生成
并生成 。通过两步制备共产生
。通过两步制备共产生 质量为
质量为
您最近一年使用:0次
解题方法
3 . 常温下ClO2为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。ClO2可通过如下反应制备: 2NaClO3+4HCl =2ClO2↑+Cl2↑+2NaCl+2H2O。现往足量NaClO3中通入56L HCl(标况)气体制ClO2,请计算:
(1)通入的HCl气体物质的量为_______ mol。
(2)若将生成的混合气体通过装有亚氯酸钠(NaClO2) 的干燥管,可吸收Cl2并生成ClO2。通过两步制备共产生ClO2的物质的量为_______ mol。
(3)ClO2的消毒效率(以单位质量得到的电子数表示)是Cl2的_______ 倍。
(1)通入的HCl气体物质的量为
(2)若将生成的混合气体通过装有亚氯酸钠(NaClO2) 的干燥管,可吸收Cl2并生成ClO2。通过两步制备共产生ClO2的物质的量为
(3)ClO2的消毒效率(以单位质量得到的电子数表示)是Cl2的
您最近一年使用:0次
解题方法
4 . 常温下ClO2为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。ClO2可通过如下反应制备:2NaClO3+4HCl=2ClO2↑+C12↑+2NaCl+2H2O。现往足量NaClO3中通入56LHCl(标况)气体制ClO2,请计算:
(1)通入的HCl气体物质的量为___ 。
(2)若将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2。通过两步制备共产生ClO2质量为多少克___ (写出计算步骤)?
(1)通入的HCl气体物质的量为
(2)若将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2。通过两步制备共产生ClO2质量为多少克
您最近一年使用:0次
解题方法
5 . 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位 mg•L-1。下面是某学生测定河水DO的操作步骤:取100mL水样于烧杯中,依次迅速加入过量MnSO4溶液、过量碱性KI溶液,充分搅拌,发生反应:2Mn2++O2+4OH-=2MnO(OH)2↓。该反应完全后,搅拌并加入过量硫酸溶液,发生反应:MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O,溶液呈弱酸性。然后从烧杯中取出20.00ml溶液,用0.002000mol•L-1 Na2S2O3溶液进行滴定,消耗Na2S2O3溶液10.00mL,发生的反应为2S2O + I2 = S4O
+ I2 = S4O + 2I-
+ 2I-
(1)滴定时消耗的n(Na2S2O3 )=_________ mol。
(2)计算水样中的DO,并写出计算过程_____________________
 + I2 = S4O
+ I2 = S4O + 2I-
+ 2I-(1)滴定时消耗的n(Na2S2O3 )=
(2)计算水样中的DO,并写出计算过程
您最近一年使用:0次
19-20高二·浙江·期末
解题方法
6 . KClO3和浓盐酸在一定温度下反应会生成红黄色的易爆物二氧化氯。
2KClO3+4HCl(浓) 2KCl+2ClO2↑+Cl2↑+2H2O
2KCl+2ClO2↑+Cl2↑+2H2O
(1)该反应中氧化剂为______ ,氧化产物为______ 。
(2)若反应生成0.1 mol Cl2,则转移的电子数为______ 。
(3)ClO2具有很强的氧化性,因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)1 kg的ClO2相当于______ kg的Cl2。(提示:Cl2和ClO2在消毒过程中均变为-1价的Cl)。
2KClO3+4HCl(浓)
 2KCl+2ClO2↑+Cl2↑+2H2O
2KCl+2ClO2↑+Cl2↑+2H2O(1)该反应中氧化剂为
(2)若反应生成0.1 mol Cl2,则转移的电子数为
(3)ClO2具有很强的氧化性,因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)1 kg的ClO2相当于
您最近一年使用:0次
名校
7 . (1)标准状况下,与5.6L的CH4气体含相同H原子数的硫化氢的质量为___ g。
(2)将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)=__ mol·L-1。若用容量瓶以质量分数为98%、密度为1.84g/cm3的浓硫酸,配制480mL浓度成0.2mol·L-1 稀硫酸,计算需要量取____ mL的浓硫酸。
(3)配平以下方程式___
___K2Cr2O7+___HCl=___KCl+___CrCl3+___Cl2↑+___H2O
上述反应中物质氧化性:___ >__ ,每生成lmolCl2时有__ 个电子发生转移,氧化剂与还原剂的物质的量之比为__ 。
(2)将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)=
(3)配平以下方程式
___K2Cr2O7+___HCl=___KCl+___CrCl3+___Cl2↑+___H2O
上述反应中物质氧化性:
您最近一年使用:0次
19-20高二·浙江·期末
8 .  和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:
和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:
______ 
______  (浓)—
(浓)—______ 
______ 
______ 
______ ______
(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内)
(2)在上述配平完成的化学方程式中用双线桥法表示出电子转移的方向和数目__________
(3)产生 ,则转移的电子的物质的量为
,则转移的电子的物质的量为________ mol。
(4) 具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是
具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的
的________ 倍(保留2位小数)。
 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:
和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:
 (浓)—
(浓)—


(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内)
(2)在上述配平完成的化学方程式中用双线桥法表示出电子转移的方向和数目
(3)产生
 ,则转移的电子的物质的量为
,则转移的电子的物质的量为(4)
 具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是
具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的
的
您最近一年使用:0次
18-19高二·浙江·期中
9 . (Ⅰ)将一定质量 和
和 的均匀混合物粉末样品分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸80.0mL。
的均匀混合物粉末样品分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸80.0mL。
(1)原均匀混合物中 =
=__________
(2)盐酸的浓度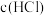 =
=__________________
(Ⅱ)臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。
(1)实验室可将氧气通过高压放电管来制取臭氧: ,将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,求其中臭氧的体积
,将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,求其中臭氧的体积__________________ L。
(2)加热条件下, 、
、 都能与铜粉反应,实验室中将氧气和臭氧的混合气体0.896L(标准状况下)盛有足量铜粉加热充分反应,混合气体被完全吸收,粉末的质量增加1.6g。求原混合气中臭氧的体积分数
都能与铜粉反应,实验室中将氧气和臭氧的混合气体0.896L(标准状况下)盛有足量铜粉加热充分反应,混合气体被完全吸收,粉末的质量增加1.6g。求原混合气中臭氧的体积分数_____________________
 和
和 的均匀混合物粉末样品分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸80.0mL。
的均匀混合物粉末样品分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸80.0mL。(1)原均匀混合物中
 =
=(2)盐酸的浓度
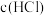 =
=(Ⅱ)臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。
(1)实验室可将氧气通过高压放电管来制取臭氧:
 ,将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,求其中臭氧的体积
,将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,求其中臭氧的体积(2)加热条件下,
 、
、 都能与铜粉反应,实验室中将氧气和臭氧的混合气体0.896L(标准状况下)盛有足量铜粉加热充分反应,混合气体被完全吸收,粉末的质量增加1.6g。求原混合气中臭氧的体积分数
都能与铜粉反应,实验室中将氧气和臭氧的混合气体0.896L(标准状况下)盛有足量铜粉加热充分反应,混合气体被完全吸收,粉末的质量增加1.6g。求原混合气中臭氧的体积分数
您最近一年使用:0次
10 . 为测定某补血剂样品[主要成分是硫酸亚铁晶体(FeSO4·7HO,M=278gmol-1)]中铁元素的含量,某化学兴趣小组设计了如下实验方案。取10片补血剂,加入一定量稀硫酸溶解后,配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.00500mol·L-1酸性KMnO4溶液滴定,重复实验平均消耗酸性KMnO4溶液10.00mL。已知滴定过程反应的离子方程式为:MnO +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
(1)若实验无损耗,则每片补血剂含FeSO4·7H2O含量为____ mg(列式计算)。
(2)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天最少需服用含FeSO4·7H2O的片剂____ 片。
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O(1)若实验无损耗,则每片补血剂含FeSO4·7H2O含量为
(2)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天最少需服用含FeSO4·7H2O的片剂
您最近一年使用:0次
2020-11-30更新
|
445次组卷
|
6卷引用:浙江省十校联盟2021届高三10月联考化学试题
浙江省十校联盟2021届高三10月联考化学试题(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省瑞安中学十校联盟2020-2021学年高三10月联考化学试题(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)



