名校
解题方法
1 . 某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC(聚合氯化铁铝)[AlFe(OH)nCl6-n]m,设计生产流程如下,请回答下列问题:

(1)用10mol·L-1的浓盐酸配制2mol·L-1的稀盐酸500mL,所取浓盐酸的体积_______ mL,所用玻璃仪器除量筒、玻璃棒和胶头滴管外,还有_______ 。
A.500mL容量瓶 B.蒸发皿 C.烧瓶
(2)写出Al2O3和Fe2O3粉末与盐酸反应的离子方程式:_______ 、_______ 。
(3)取少量酸性溶液滴加几滴KSCN试剂,溶液变为_______ 色,证明含有Fe3+。
(4)通入氯气的目的是_______ 。
(5)加入NaOH调节pH时,氢氧化钠不宜过多,生成一种红褐色沉淀,已知Al(OH)3+NaOH=NaAlO2+2H2O。写出溶液中Al3+和Fe3+分别与过量NaOH反应的离子方程式:_______ 、_______ 。

(1)用10mol·L-1的浓盐酸配制2mol·L-1的稀盐酸500mL,所取浓盐酸的体积
A.500mL容量瓶 B.蒸发皿 C.烧瓶
(2)写出Al2O3和Fe2O3粉末与盐酸反应的离子方程式:
(3)取少量酸性溶液滴加几滴KSCN试剂,溶液变为
(4)通入氯气的目的是
(5)加入NaOH调节pH时,氢氧化钠不宜过多,生成一种红褐色沉淀,已知Al(OH)3+NaOH=NaAlO2+2H2O。写出溶液中Al3+和Fe3+分别与过量NaOH反应的离子方程式:
您最近一年使用:0次
2023-08-25更新
|
127次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州兴义第一中学2022-2023学年高一下学期第三次月考化学试题
解题方法
2 . 锆产品的主要原料是锆英砂,全球90%的氧氯化锆(ZrOCl2)来源于中国。氧氯化锆可溶于水,微溶于盐酸,工业上以锆英砂(含91.5%ZrSiO4,杂质不与NaOH溶液反应)为原料生产ZrOCl2的一种工艺流程如图所示。
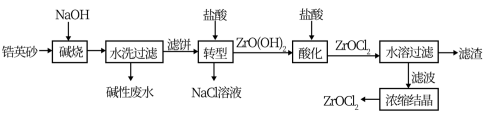
已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是____ ,“碱烧”时ZrSiO4生成了Na2ZrO3和另一种钠盐X,X的化学式为___ ,X的用途是___ (写一种)。
(2)“转型”时发生反应的化学方程式为___ 。
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是___ 。
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是___ 。
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成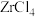 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为___ 。
(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为___ t。

已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是
(2)“转型”时发生反应的化学方程式为
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成
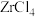 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为
您最近一年使用:0次
2021-10-01更新
|
516次组卷
|
5卷引用:贵州省黔西南州2021~2022学年高二上学期期中考试化学试题
贵州省黔西南州2021~2022学年高二上学期期中考试化学试题河南省偃师市第一高级中学2022届高三阶段性测试化学试题福建省南平市2022届高三10月联考化学试卷重庆市2021-2022学年高二上学期期中考试化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-测试
3 . 黄铜矿(主要成分为CuFeS2,还含有少量的SiO2和Al2O3)是制取铜及其化合物的主要原料之一,还可用于制备绿矾(化学式为FeSO4·7H2O)。
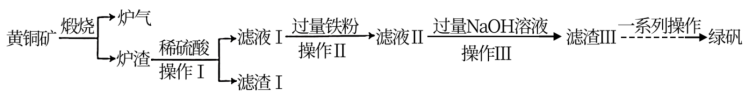
(1)黄铜矿“煅烧”时发生的反应为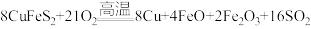 。若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是
。若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是___________ (填元素符号)。
(2)“滤渣Ⅰ”的主要成分为___________ ,“滤渣Ⅲ”的主要成分为___________ 。(填化学式)
(3)“滤液Ⅱ”中含有的金属阳离子有___________ (填离子符号)。
(4)上述“煅烧”过程会产生“炉气”(主要成分为SO2)。下列对“炉气”的处理方案中合理的是___________ (填标号)。
A.高空排放 B.用于制备硫酸
C.用纯碱溶液吸收制Na2SO3 D.用浓硫酸吸收
(5)“操作Ⅰ”的名称为___________ 。

(1)黄铜矿“煅烧”时发生的反应为
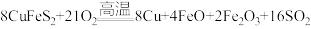 。若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是
。若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是(2)“滤渣Ⅰ”的主要成分为
(3)“滤液Ⅱ”中含有的金属阳离子有
(4)上述“煅烧”过程会产生“炉气”(主要成分为SO2)。下列对“炉气”的处理方案中合理的是
A.高空排放 B.用于制备硫酸
C.用纯碱溶液吸收制Na2SO3 D.用浓硫酸吸收
(5)“操作Ⅰ”的名称为
您最近一年使用:0次
4 . 活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:

(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________ 。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________ 时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________ ,验证溶质所含阳离子的方法是_____________ 。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________ 。

(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为
(3)A溶液中主要含有的溶质是
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式
您最近一年使用:0次
2019-09-26更新
|
254次组卷
|
5卷引用:贵州省望黔西南布依族苗族自治州谟民族中学2019-2020学年高三上学期期末考试化学试题



