名校
1 . 2021年《科学》杂志刊登了用 为原料,不依赖光合作用,可人工合成淀粉,其前两步的合成路线如下。用
为原料,不依赖光合作用,可人工合成淀粉,其前两步的合成路线如下。用 表示阿伏加德罗常数值,下列说法正确的是。
表示阿伏加德罗常数值,下列说法正确的是。

 为原料,不依赖光合作用,可人工合成淀粉,其前两步的合成路线如下。用
为原料,不依赖光合作用,可人工合成淀粉,其前两步的合成路线如下。用 表示阿伏加德罗常数值,下列说法正确的是。
表示阿伏加德罗常数值,下列说法正确的是。
A. 中含有σ键的数目为 中含有σ键的数目为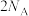 |
B. 的甲醇水溶液中含有的 的甲醇水溶液中含有的 数为 数为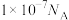 |
C.步骤Ⅱ中每消耗 转移的电子数为 转移的电子数为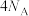 |
D.90g甲醛和葡萄糖的混合物中含有的氧原子数为 |
您最近一年使用:0次
2023-02-03更新
|
481次组卷
|
2卷引用:广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题
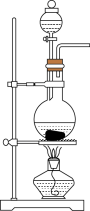
2 . 磺酰氯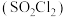 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量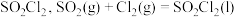 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知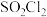 的熔点为
的熔点为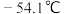 ,沸点为
,沸点为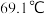 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。
回答下列问题。 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。
(2)导管a的作用是___________ ;仪器b中的试剂是___________ 。
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是___________ 。
(4)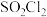 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为___________ 。
(5)若反应中消耗的氯气体积为 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为___________ (产率:实际产量/理论产量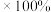 )。
)。
(6)已知酸性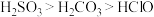 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为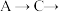
___________  ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。
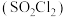 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量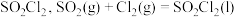 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知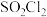 的熔点为
的熔点为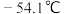 ,沸点为
,沸点为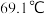 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。回答下列问题。

 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。A. 的硫酸和 的硫酸和 | B. 的硝酸和 的硝酸和 固体 固体 |
C.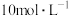 的硫酸和 的硫酸和 固体 固体 | D. 的硫酸和 的硫酸和 固体 固体 |
(2)导管a的作用是
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是
(4)
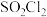 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为(5)若反应中消耗的氯气体积为
 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为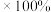 )。
)。(6)已知酸性
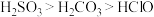 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为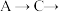
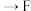 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为
您最近一年使用:0次
2024-02-23更新
|
156次组卷
|
2卷引用:广东省深圳实验学校高中部2023-2024学年高一上学期第三阶段考试化学试题
名校
3 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
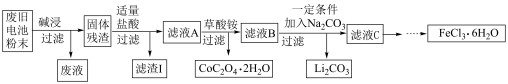
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
257次组卷
|
3卷引用:广东省茂名市七校2023-2024学年高一上学期12月联考化学试题
名校
解题方法
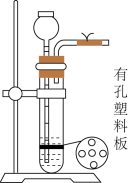
4 . 氯化亚砜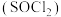 在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备
在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备 。
。
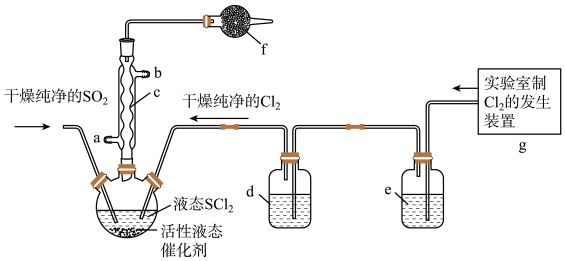
已知:① 是一种液态化合物,沸点为77℃
是一种液态化合物,沸点为77℃
② 遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
③实验室合成 原理:
原理:
请回答以下问题:
(1)仪器c的名称是_______ ,f中的最佳试剂是_______ (填字母符号)。
A.碱石灰 B.浓硫酸 C. 溶液 D.无水氯化钙
溶液 D.无水氯化钙
(2)实验室用浓盐酸与 粉末反应制
粉末反应制 的化学方程式为
的化学方程式为________ 。
(3) 与水反应的化学方程式为
与水反应的化学方程式为_______ 。
(4)下列三种制备 的方案中最佳选择是
的方案中最佳选择是_________ .
(5)装置g中产生的 经过e、d后进入三颈烧瓶,e中的试剂为
经过e、d后进入三颈烧瓶,e中的试剂为_____ 。
(6)实验结束后,将三颈烧瓶中混合物分离开的实验操作是_____ (已知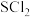 的沸点为50℃);若反应中消耗
的沸点为50℃);若反应中消耗 的体积为
的体积为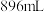 (已转化为标准状况,
(已转化为标准状况, 足量),最后得到
足量),最后得到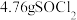 ,则
,则 的产率为
的产率为_______ (已知产率=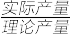 ×100%)。
×100%)。
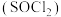 在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备
在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备 。
。
已知:①
 是一种液态化合物,沸点为77℃
是一种液态化合物,沸点为77℃②
 遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生③实验室合成
 原理:
原理:
请回答以下问题:
(1)仪器c的名称是
A.碱石灰 B.浓硫酸 C.
 溶液 D.无水氯化钙
溶液 D.无水氯化钙(2)实验室用浓盐酸与
 粉末反应制
粉末反应制 的化学方程式为
的化学方程式为(3)
 与水反应的化学方程式为
与水反应的化学方程式为(4)下列三种制备
 的方案中最佳选择是
的方案中最佳选择是方案 | 甲 | 乙 | 丙 |
| 发生装置 |
|
|
|
| 所选试剂 | 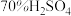 和 和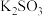 粉末 粉末 | 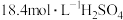 铜片 铜片 | 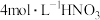 和 和 粉末 粉末 |
 经过e、d后进入三颈烧瓶,e中的试剂为
经过e、d后进入三颈烧瓶,e中的试剂为(6)实验结束后,将三颈烧瓶中混合物分离开的实验操作是
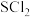 的沸点为50℃);若反应中消耗
的沸点为50℃);若反应中消耗 的体积为
的体积为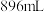 (已转化为标准状况,
(已转化为标准状况, 足量),最后得到
足量),最后得到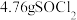 ,则
,则 的产率为
的产率为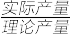 ×100%)。
×100%)。
您最近一年使用:0次
2020-08-12更新
|
293次组卷
|
2卷引用:广东省湛江市第二中学2022-2023学年高一下学期期末考试化学试题