解题方法
1 . 下列离子的检验说法正确的是
| A.用洁净的铂丝蘸取某溶液于酒精灯外焰上灼烧,火焰呈黄色则证明溶液中含有K+ |
| B.某溶液先加氯水,再加KSCN溶液,出现红色则证明一定含有Fe2+ |
C.某溶液加入稀盐酸,产生的气体通入澄清石灰水,溶液变浑浊则证明一定有 |
| D.某溶液先加足量稀HNO3,再加少量AgNO3溶液,生成白色沉淀则证明一定有Cl﹣ |
您最近一年使用:0次
名校
解题方法
2 . 某实验小组为了证明过氧化钠可在呼吸面具和潜水艇中做供氧剂,设计了如图实验装置进行实验,则下列说法不正确的是
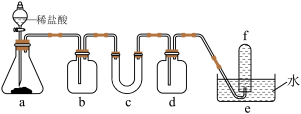
A.c中盛放的是 ,装置中会发生2个反应 ,装置中会发生2个反应 |
B.b中盛放的是浓硫酸,作用是干燥 |
| C.c中会观察到固体颜色逐渐变白,伴有发热的现象 |
D.d中盛放的是NaOH溶液,作用是吸收多余的 |
您最近一年使用:0次
2023-12-06更新
|
142次组卷
|
3卷引用:广东省东莞市东莞中学2023-2024学年高一上学期期中考试化学试卷
名校
解题方法
3 . 化学小组欲测定某补铁剂中铁元素的价态,设计并进行了如下实验:
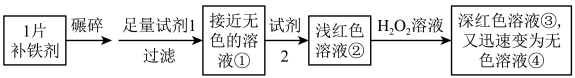
已知:该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸),KSCN中的硫元素为﹣2价。下列说法不正确的是

已知:该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸),KSCN中的硫元素为﹣2价。下列说法不正确的是
| A.试剂1是盐酸,试剂2是KSCN溶液 |
B.加入 溶液后,溶液由浅红色变为深红色,说明溶液②中含有 溶液后,溶液由浅红色变为深红色,说明溶液②中含有 |
C.深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的 与 与 发生了化学反应 发生了化学反应 |
D.取少量无色溶液④于试管中,滴入KSCN溶液,溶液变红,证明补铁剂中只含有 |
您最近一年使用:0次
2023-02-10更新
|
218次组卷
|
3卷引用:广东省揭阳市惠来县第一中学2022-2023学年高一下学期第一次月考化学试题
4 .  常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。
常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。 各原子最外层均达到8电子稳定结构,极易与水反应生成淡黄色沉淀和能使品红溶液褪色的气体。下列说法不正确的是
各原子最外层均达到8电子稳定结构,极易与水反应生成淡黄色沉淀和能使品红溶液褪色的气体。下列说法不正确的是
 常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。
常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。 各原子最外层均达到8电子稳定结构,极易与水反应生成淡黄色沉淀和能使品红溶液褪色的气体。下列说法不正确的是
各原子最外层均达到8电子稳定结构,极易与水反应生成淡黄色沉淀和能使品红溶液褪色的气体。下列说法不正确的是A. 中硫元素化合价是+1 中硫元素化合价是+1 |
B. 的结构式是 的结构式是 |
C. 与水反应时,氧化产物与还原产物的物质的量之比为 与水反应时,氧化产物与还原产物的物质的量之比为 |
D.向 中滴加 中滴加 溶液,有白色沉淀产生,则证明 溶液,有白色沉淀产生,则证明 中含有 中含有 |
您最近一年使用:0次
2023-07-08更新
|
143次组卷
|
4卷引用:广东省汕尾市2022-2023学年高一下学期期末教学质量监测化学试题
名校
解题方法
5 . X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4,请回答下列问题:
(1)用电子式表示 的形成过程
的形成过程_____________________ 。
(2)W在周期表中的位置是________________ 。
(3)X、Y、Z形成化合物的电子式为______ , 中含有的化学键类型为
中含有的化学键类型为________________ 。
(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是__________ (用元素的离子符号表示)。
(5)下列说法能证明非金属性Q强于R的是______ (填字母)。
a.简单阴离子的还原性:
b.简单氢化物热稳定性: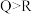
c.氧化物对应的水化物的酸性: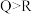
(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是___________ 。
(1)用电子式表示
 的形成过程
的形成过程(2)W在周期表中的位置是
(3)X、Y、Z形成化合物的电子式为
 中含有的化学键类型为
中含有的化学键类型为(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是
(5)下列说法能证明非金属性Q强于R的是
a.简单阴离子的还原性:

b.简单氢化物热稳定性:
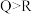
c.氧化物对应的水化物的酸性:
(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是
您最近一年使用:0次
2023-04-23更新
|
90次组卷
|
2卷引用:广东省惠州市惠阳区部分学校2022-2023学年高一下学期期中联考化学试题
名校
解题方法
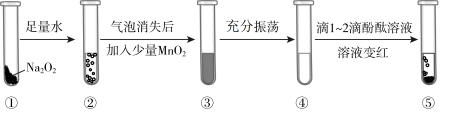
6 . 某小组通过如图所示实验,探究 与水的反应。
与水的反应。
下列说法中不正确的是
 与水的反应。
与水的反应。
下列说法中不正确的是
| A.②和③中产生的气泡,均可使带余烬的木条复燃 |
B.充分振荡后,④中 粉末溶解 粉末溶解 |
| C.⑤中溶液变红,说明有碱性物质生成 |
D.③~⑤的现象证明 与水的反应过程中存在: 与水的反应过程中存在: 和 和 两个反应 两个反应 |
您最近一年使用:0次
2023-02-26更新
|
337次组卷
|
10卷引用:广东省广州市番禺区2022-2023学年高一下学期开学统考测试化学试题
广东省广州市番禺区2022-2023学年高一下学期开学统考测试化学试题广东省茂名市第五中学2021-2022学年高一上学期期中考试化学试题广东省珠海市第二中学2022-2023学年高一上学期11月期中考试化学试题(已下线)第01讲 钠及其化合物-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)江西省南昌市江西科技学院附属中学2023-2024学年高一上学期期中考试化学试卷 山东省威海市2020-2021学年高一上学期期末考试化学试题浙江省金华市第一中学2021-2022学年高一上学期期初摸底考试化学试题河北武强中学2021-2022学年高一上学期期中考试化学试题山东省潍坊市临朐县实验中学2021-2022学年高一下学期开学收心考试化学试题(已下线)【2022】【高一上】【期中考】【杭四吴山】【高中化学】【宋永洁收集】
名校
7 . 用如图所示实验装置进行相关实验探究,下列说法不合理的是

| A.图1证明NaHCO3受热易分解 | B.图2制备Fe(OH)3胶体 |
| C.图3证明Cl2能与烧碱溶液反应 | D.图4探究钠与Cl2的反应 |
您最近一年使用:0次
2022-12-17更新
|
528次组卷
|
12卷引用:广东省深圳大学附属实验中学2023-2024学年高一上学期期中测试化学试题
广东省深圳大学附属实验中学2023-2024学年高一上学期期中测试化学试题广东省部分名校2022-2023学年高一上学期教学质量检测化学试题山西省晋中市平遥县第二中学校2022-2023学年高一下学期3月月考化学试题湖南省湘潭市2022-2023学年高一上学期1月期末考试化学试题陕西省西安市莲湖区2022-2023学年高一上学期1月期末化学试题(已下线)专项04 化学实验基础知识与基本技能-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)河南省安阳市龙安高级中学2023-2024学年高一上学期期中考试化学试卷河南省郑州市部分重点中学2022-2023学年高一上学期第三次考试化学试题云南省楚雄彝族自治州2022-2023学年高一上学期期末教育学业质量监测化学试题河南省新乡市2022-2023学年高一上学期选科调研第二次测试化学试题河南省新乡市第一中学2022-2023学年高一上学期12月期中考试化学试题山西省大同市第一中学校2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
8 . 已知下述三个实验均能发生化学反应,下列判断正确的是
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A.实验①中铁钉是还原剂 | B.实验②中氯水主要起作用的微粒是HClO |
| C.实验③中发生的是置换反应 | D.实验③证明金属性Cu>Fe |
您最近一年使用:0次
2024-01-24更新
|
74次组卷
|
2卷引用:广东省广州市三校(广附,铁一,广外)2023-2024学年高一上学期期末联考化学试题
名校
解题方法
9 . 实验室用废金属矿渣(主要成分是Al、Al2O3、Fe2O3、Fe3O4)为原料制备净水剂高铁酸钾(K2FeO4),流程如下:

(1)试剂a为___________ ,写出加入试剂a后Al发生的化学反应方程式___________ 。
(2)试剂b可以选择下列试剂___________ 。
①氨水②KI③H2O2④铁粉
并写出使用试剂b时,溶液中发生的离子反应方程式___________ 。证明溶液中试剂b加入的量不足的方法是___________ 。
(3)Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,KClO转化为KCl,制备过程中氧化剂与还原剂的物质的量之比为___________ 。
(4)实验室可用干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,制备1molNa2FeO4,反应转移的电子数目为___________ 。

(1)试剂a为
(2)试剂b可以选择下列试剂
①氨水②KI③H2O2④铁粉
并写出使用试剂b时,溶液中发生的离子反应方程式
(3)Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,KClO转化为KCl,制备过程中氧化剂与还原剂的物质的量之比为
(4)实验室可用干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,制备1molNa2FeO4,反应转移的电子数目为
您最近一年使用:0次
2024-01-24更新
|
201次组卷
|
2卷引用:广东省广州市三校(广附,铁一,广外)2023-2024学年高一上学期期末联考化学试题
名校
10 . “84消毒液”被广泛应用于物体表面杀菌消毒,化学兴趣小组设计了如图的实验装置制氯气探究氯气的性质并制备少量84消毒液:
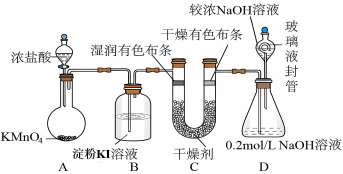
(1)盛放浓盐酸的仪器名称___________ ,酸性高锰酸钾作为强氧化剂其还原产物一般为Mn2+,装置A中反应的离子方程式是:___________ 。
(2)下列物质均可用于干燥气体,为了验证氯气是否具有漂白性,装置C应选择___________。
(3)装置D中的玻璃液封管中NaOH溶液的作用是___________ 。
(4)B装置可以观察到溶液开始变蓝后褪色,为探究其褪色的原因,取少许B溶液,滴加几滴碘水,溶液恢复蓝色,通过实验结果证明蓝色褪去的原因可能是___________ 。
(5)现在对锥形瓶中制备的消毒液进行定性和定量探究。
i.消毒液漂白性的探究,已知消毒液中起漂白作用的是HClO分子。
上述实验可以得到消毒液的漂白性强弱可能受___________ 影响。
ii.用Na2S2O3溶液和KI定量测定NaClO含量,其原理为: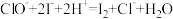 ;
; 。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到___________ 现象时,停止加入Na2S2O3。实验结束,测得共消耗20mLNa2S2O3,则计算消毒液中NaClO的浓度为___________ mol/L。

(1)盛放浓盐酸的仪器名称
(2)下列物质均可用于干燥气体,为了验证氯气是否具有漂白性,装置C应选择___________。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.无水CaCl2 |
(3)装置D中的玻璃液封管中NaOH溶液的作用是
(4)B装置可以观察到溶液开始变蓝后褪色,为探究其褪色的原因,取少许B溶液,滴加几滴碘水,溶液恢复蓝色,通过实验结果证明蓝色褪去的原因可能是
(5)现在对锥形瓶中制备的消毒液进行定性和定量探究。
i.消毒液漂白性的探究,已知消毒液中起漂白作用的是HClO分子。
| 实验组 | 试剂 | 现象 |
| ① | 10mL消毒液+1mL蒸馏水+红色纸条 | 2min后纸条红色褪去 |
| ② | 10mL消毒液+1mL稀硫酸+红色纸条 | 30s后纸条红色褪去 |
| ③ | 10mL消毒液+1mL稀NaOH+红色纸条 | 2min后纸条红色稍变浅 |
ii.用Na2S2O3溶液和KI定量测定NaClO含量,其原理为:
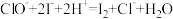 ;
; 。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
。取20mL锥形瓶中的消毒液,加入过量的硫酸酸化的KI溶液,并加入几滴淀粉,再向溶液中逐滴加入0.2mol/L的Na2S2O3,当观察到
您最近一年使用:0次
2024-01-24更新
|
115次组卷
|
2卷引用:广东省广州市三校(广附,铁一,广外)2023-2024学年高一上学期期末联考化学试题



