名校
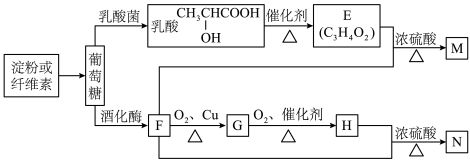
1 . 以富含淀粉或纤维素的农林产品为原料,制备生活中的某些有机物。
(1)葡萄糖的分子式为_______ ,乳酸分子中的官能团的名称为_______ 。
(2)下列说法正确的是_______。
(3)G在一定条件下可转化为F,则该反应的反应类型是_______ 。
(4)久置的M自身会发生聚合反应得到弹性较好的聚合物,请写出该聚合物的结构简式:_______ 。
(5)写出“F→G”、“E+F→M”两个反应的化学方程式(有机物用结构简式表示)
“F→G”:_______
“E+F→M”:_______
(1)葡萄糖的分子式为
(2)下列说法正确的是_______。
| A.淀粉和纤维素互为同分异构体 |
| B.E和H属于同系物、M和N也属于同系物 |
| C.E、F和G均能使酸性高锰酸钾溶液褪色 |
| D.乳酸、F和H均能与钠、氢氧化钠溶液发生反应 |
(3)G在一定条件下可转化为F,则该反应的反应类型是
(4)久置的M自身会发生聚合反应得到弹性较好的聚合物,请写出该聚合物的结构简式:
(5)写出“F→G”、“E+F→M”两个反应的化学方程式(有机物用结构简式表示)
“F→G”:
“E+F→M”:
您最近一年使用:0次
名校
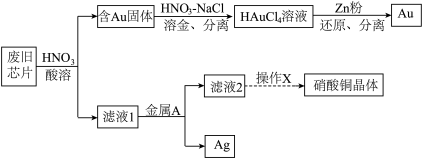
2 . 废旧芯片中常含有大量的单质Si和少量的Au、Ag、Cu等金属。某化学兴趣小组设计了如下图所示方法回收废旧芯片中的Au、Ag并制取硝酸铜晶体[Cu(NO3)2·6H2O]。 。
。
请回答下列问题:
(1)为加快酸溶速率,可采取的两种措施为:_______ 、_______ 。
(2)浓、稀HNO3均可作酸溶试剂,溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量多的反应的化学方程式_______ 。
(3)写出过量的锌粉还原HAuCl4溶液生成金的离子方程式_______ 。
(4)金属A的名称是_______ 。
(5)操作X包括了_______ 过滤、洗涤、晾干。
(6)上述过程产生的NO和NO2等氮氧化物会污染空气,可用如下方法处理:
①氨气催化吸收法:已知1mol氨气恰好能将含NO和NO2共0.9mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比_______ 。
②酸化的Ca(ClO)2溶液吸收法:NO能被氧化成NO 。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是_______ 。
 。
。请回答下列问题:
(1)为加快酸溶速率,可采取的两种措施为:
(2)浓、稀HNO3均可作酸溶试剂,溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量多的反应的化学方程式
(3)写出过量的锌粉还原HAuCl4溶液生成金的离子方程式
(4)金属A的名称是
(5)操作X包括了
(6)上述过程产生的NO和NO2等氮氧化物会污染空气,可用如下方法处理:
①氨气催化吸收法:已知1mol氨气恰好能将含NO和NO2共0.9mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比
②酸化的Ca(ClO)2溶液吸收法:NO能被氧化成NO
 。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
。研究不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是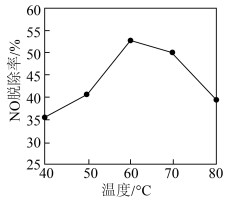
您最近一年使用:0次
名校
解题方法
3 . 实验室用 还原
还原 制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是 中硅元素为+4价,沸点为
中硅元素为+4价,沸点为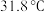 ,在空气中易自燃,遇水会剧烈反应生成两种酸和一种气体。
,在空气中易自燃,遇水会剧烈反应生成两种酸和一种气体。
 还原
还原 制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
 中硅元素为+4价,沸点为
中硅元素为+4价,沸点为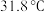 ,在空气中易自燃,遇水会剧烈反应生成两种酸和一种气体。
,在空气中易自燃,遇水会剧烈反应生成两种酸和一种气体。| A.装置I也适用于生石灰与浓氨水反应制备氨气 |
| B.装置II中的试剂是浓硫酸、装置III可采取冰水浴 |
| C.实验时,应先加热管式炉,再打开活塞K |
D. 与水反应的方程式为 与水反应的方程式为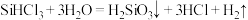 |
您最近一年使用:0次
4 . 乙烯( )是一种重要的有机化工原料,其产量可以用来衡量一个国家的石油化工发展水平,回答下列问题。
)是一种重要的有机化工原料,其产量可以用来衡量一个国家的石油化工发展水平,回答下列问题。
(1)乙烯分子中的官能团名称为___________ (填“碳碳双键”或“碳碳三键”);从有机物的类别来看,乙烯属于___________ (填“饱和烃”或“不饱和烃”)。
(2)工业上可用乙烯制备乙醇,其反应的化学方程式为: 。该反应属于反应
。该反应属于反应___________ (填“加成”或“取代”)。
(3)在一定条件下,乙烯发生加聚反应生成重要的高分子化合物聚乙烯(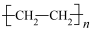 ),其反应的化学方程式为
),其反应的化学方程式为___________ 。
 )是一种重要的有机化工原料,其产量可以用来衡量一个国家的石油化工发展水平,回答下列问题。
)是一种重要的有机化工原料,其产量可以用来衡量一个国家的石油化工发展水平,回答下列问题。(1)乙烯分子中的官能团名称为
(2)工业上可用乙烯制备乙醇,其反应的化学方程式为:
 。该反应属于反应
。该反应属于反应(3)在一定条件下,乙烯发生加聚反应生成重要的高分子化合物聚乙烯(
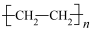 ),其反应的化学方程式为
),其反应的化学方程式为
您最近一年使用:0次
名校
5 . 化学教材后的元素周期表为通用元素周期表,2019年是门捷列夫提出元素周期表诞生150周年,联合国宣布2019年为“国际化学元素周期表年”。同年,欧洲化学学会(EuChemS)发布了1张“扭曲”的元素周期表,指出:由于过度使用,部分元素可能在未来的100年内从地球上消失。每种元素在周期表上所占面积的大小,呈现出元素的稀缺程度。___________ ;④是手机电池的主要构成元素,④的单质在③的常见单质中点燃的方程式为___________ 。
(2)用电子式表示①与③形成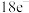 化合物的过程:
化合物的过程:___________ 。
(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有___________ (填序号)。___________ 。
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为___________ 。
② 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与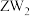 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式___________ 。
(2)用电子式表示①与③形成
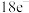 化合物的过程:
化合物的过程:(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有
a. 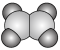 b.
b.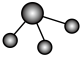 c.
c. 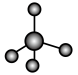 d.
d.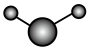
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。
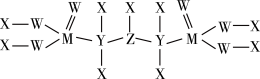
 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为②
 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与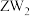 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 未来电池研发领域涌现出的纸电池像纸一样轻薄柔软,下右图为纸电池的结构示意图。现在用镁片、铝片和滤纸作为电极材料和隔离膜,先后用食盐水和溶液Y做为电解质溶液制作了两个简易电池,并用电流表测试这两个电池,得到如下结果:
错误 的是
| 电流表指针偏向 | |
| 食盐水 | a |
| 溶液Y | b |

A.溶液Y若为氢氧化钠溶液,则铝电极发生的反应为: |
| B.当用食盐水做电解质溶液时,每消耗0.48g镁,理论上消耗气体质量为0.32g |
| C.当电路中通过0.48mol电子时,消耗铝的质量为5.4g,则电子的利用率为80% |
| D.饱和食盐水做电解质溶液时,电路中电子的流向为:Mg→Al→饱和食盐水→Mg |
您最近一年使用:0次
名校
解题方法
7 . 硫及其化合物是十分重要的化工原料。
Ⅰ.工业上一般以硫磺或其他含硫矿物为原料制备硫酸。金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。___________ 。
(2)用98.3%的浓硫酸吸收 而不用水的原因为
而不用水的原因为___________ 。
Ⅱ.某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气)___________ (答操作)。
(4)已知开始时量气管读数为 mL,最终读数为
mL,最终读数为 mL(均折合成标准状况,且
mL(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为___________ mol/L。
Ⅲ.实验小组为探究 与
与 溶液的反应,进行了以下实验。
溶液的反应,进行了以下实验。
实验一:用如下装置(夹持、加热仪器略)制备 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为
溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为 、(微溶)或二者的混合物。
、(微溶)或二者的混合物。 溶液,未出现白色沉淀。
溶液,未出现白色沉淀。
(5)实验二可判断B中不含 。做出判断的理由为
。做出判断的理由为___________ 。
(6)由实验二可知,实验一中, 与
与 溶液反应的离子方程式是
溶液反应的离子方程式是___________ 。
根据物质性质分析, 与
与 溶液应该可以发生氧化还原反应。
溶液应该可以发生氧化还原反应。
实验三:将实验一所得混合物隔绝空气放置一段时间,有Ag和 生成。
生成。
(7)根据实验一、二、三,可得结论为___________ 。
Ⅰ.工业上一般以硫磺或其他含硫矿物为原料制备硫酸。金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。

(2)用98.3%的浓硫酸吸收
 而不用水的原因为
而不用水的原因为Ⅱ.某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气)

(4)已知开始时量气管读数为
 mL,最终读数为
mL,最终读数为 mL(均折合成标准状况,且
mL(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为Ⅲ.实验小组为探究
 与
与 溶液的反应,进行了以下实验。
溶液的反应,进行了以下实验。实验一:用如下装置(夹持、加热仪器略)制备
 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为
溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为 、(微溶)或二者的混合物。
、(微溶)或二者的混合物。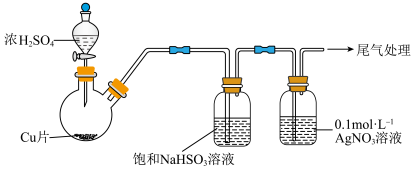
 溶液,未出现白色沉淀。
溶液,未出现白色沉淀。(5)实验二可判断B中不含
 。做出判断的理由为
。做出判断的理由为(6)由实验二可知,实验一中,
 与
与 溶液反应的离子方程式是
溶液反应的离子方程式是根据物质性质分析,
 与
与 溶液应该可以发生氧化还原反应。
溶液应该可以发生氧化还原反应。实验三:将实验一所得混合物隔绝空气放置一段时间,有Ag和
 生成。
生成。(7)根据实验一、二、三,可得结论为
您最近一年使用:0次
8 . 下列叙述正确的有几项
①常温下,浓硫酸可以用铝槽车盛装,说明浓硫酸不与铝反应
②将浓硫酸滴加到胆矾上,固体由蓝色变为白色,体现了浓硫酸的吸水性
③ 固体和浓硫酸共热可以制取
固体和浓硫酸共热可以制取 ,同理
,同理 固体和浓硫酸共热也可以制
固体和浓硫酸共热也可以制 气体
气体
④为了加快锌粒和 硫酸反应制氢气的速率,可改用锌粉或
硫酸反应制氢气的速率,可改用锌粉或 的硫酸
的硫酸
⑤向浓硝酸中插入红热的木炭,产生红棕色气体,说明木炭和浓硝酸反应生成了
⑥将 浓溶液滴加到某溶液中加热,放出的气体能使湿润的蓝色石蕊试纸变红,说明该溶液中一定含有
浓溶液滴加到某溶液中加热,放出的气体能使湿润的蓝色石蕊试纸变红,说明该溶液中一定含有
⑦将 样品溶于稀硫酸后,滴加
样品溶于稀硫酸后,滴加 溶液,溶液变红,说明样品已变质
溶液,溶液变红,说明样品已变质
⑧将 和气体
和气体 一起通入到
一起通入到 溶液中,有白色沉淀产生,则气体
溶液中,有白色沉淀产生,则气体 可能有氧化性
可能有氧化性
①常温下,浓硫酸可以用铝槽车盛装,说明浓硫酸不与铝反应
②将浓硫酸滴加到胆矾上,固体由蓝色变为白色,体现了浓硫酸的吸水性
③
 固体和浓硫酸共热可以制取
固体和浓硫酸共热可以制取 ,同理
,同理 固体和浓硫酸共热也可以制
固体和浓硫酸共热也可以制 气体
气体④为了加快锌粒和
 硫酸反应制氢气的速率,可改用锌粉或
硫酸反应制氢气的速率,可改用锌粉或 的硫酸
的硫酸⑤向浓硝酸中插入红热的木炭,产生红棕色气体,说明木炭和浓硝酸反应生成了

⑥将
 浓溶液滴加到某溶液中加热,放出的气体能使湿润的蓝色石蕊试纸变红,说明该溶液中一定含有
浓溶液滴加到某溶液中加热,放出的气体能使湿润的蓝色石蕊试纸变红,说明该溶液中一定含有
⑦将
 样品溶于稀硫酸后,滴加
样品溶于稀硫酸后,滴加 溶液,溶液变红,说明样品已变质
溶液,溶液变红,说明样品已变质⑧将
 和气体
和气体 一起通入到
一起通入到 溶液中,有白色沉淀产生,则气体
溶液中,有白色沉淀产生,则气体 可能有氧化性
可能有氧化性| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
解题方法
9 . “绿水青山就是金山银山”。近年来,为了治理塑料污染对环境造成的危害,我国推出了一系列政策措施。
下列物品不属于塑料制品的是
下列物品不属于塑料制品的是
| A.一次性泡沫包装盒 | B.一次性纸质茶水杯 |
| C.聚丙烯医用注射器 | D.聚乙烯食品包装袋 |
您最近一年使用:0次
10 . 糖类是重要的营养物质,下列说法错误的是
| A.糖类是人体能量的主要来源 | B.农作物中的淀粉可以用于酿酒 |
| C.葡萄糖和蔗糖分子结构相同 | D.糖尿病人应少吃含糖食品 |
您最近一年使用:0次



