真题
名校
1 . 用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
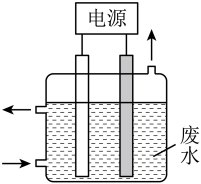

| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
您最近一年使用:0次
2019-01-30更新
|
5602次组卷
|
56卷引用:安徽省淮北市第一中学2017-2018学年高二上学期第一次月考化学试题
安徽省淮北市第一中学2017-2018学年高二上学期第一次月考化学试题安徽省淮北市第一中学2017-2018学年高一上学期第一次月考(开学考)化学试题2015年全国普通高等学校招生统一考试化学(四川卷)2016届湖南省浏阳第一中学高三上学期入学考试化学试卷2016届湖北省天门中学高三优录班8月月考化学试卷2016届福建省三明市第一中学高三上学期第二次月考化学试卷2015-2016学年辽宁省沈阳二中高二上12月月考化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷2015-2016学年浙江省东阳中学高二上学期12月阶段测化学试卷2015-2016学年湖南省株洲二中高二上学期期末化学试卷2015-2016学年吉林大学附属中学高二上期末化学试卷2015-2016学年河北省石家庄一中高二上学期期末化学试卷2015-2016学年浙江省湖州中学高二上学期期中化学试卷浙江省宁波市效实中学2015-2016学年高一下期中化学卷2016届海南省农垦中学高三考前押题理综化学试卷2015-2016学年山东济宁微山一中高二下第二次月考化学试卷2016届河南省三门峡市灵宝三中高三上第四次质检化学试卷2017届湖北省孝感高级中学高三上9月调考化学试卷2017届湖北省沙市中学高三上学期第三次考试化学试卷2017届广西桂林十八中高三上10月月考化学试卷2016-2017学年辽宁省实验中学分校高二上期中化学卷2017届河北省冀州中学高三(高复班)上学期一轮检测(二)化学试卷2017届天津市红桥区高三上学期期末考试(下学期开学考试)化学试卷山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题六对接高考精练--电解池、金属的腐蚀与防护辽宁省实验中学分校2016-2017学年高二上学期期中考试化学试题福建省厦门双十中学2017-2018学年高二下学期期中考试化学试题鲁科版高二上学期化学选修一:检测题(三)【全国百强校】河北省衡水市武邑中学2018-2019学年高二上学期第一次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)福建省晋江市南侨中学2019-2020学年高二上学期第一阶段考试化学试题黑龙江省哈尔滨市尚志市尚志中学2019-2020学年高二上学期第三次月考化学试题云南省丽江市宁蒗县第一中学2019—2020学年高二上学期期末考试化学试题2020年人教版高二化学选修4化学反应原理第4章《电化学基础》练习3-1广西桂林第十八中学2016届高三上学期第三次月考化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训黑龙江省绥化市安达市第七中学2019-2020学年高二下学期期中考试化学试题河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第二节 电解池 教材帮北京市新学道临川学校2021届高三上学期第一次月考化学试题(已下线)第12单元 电化学基础(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题福建省福州市第十一中学2020-2021学年高二上学期期中质量检测化学试题(已下线)4.2.2 电解原理的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)吉林油田高级中学2019-2020学年高一下学期期末考试化学试题(已下线)练习3 电解池2020-2021学年【补习教材·寒假作业】高二化学(苏教版)湖北省沙洋县沙洋中学2020-2021学年高二12月月考化学试题上海市吴淞中学2021-2022学年高三上学期期中考试化学试题广东省华南师范大学附属中学2021-2022学年高三上学期1月模拟考试化学试题河南省南阳市六校2022-2023学年高二上学期第一次月考化学试题 广东省梅州市梅江区梅州中学2021-2022学年高三下学期开学模拟考试化学试题第4节 金属的腐蚀与防护作业(七) 电解原理的应用广东省江门市新会第一中学2023-2024学年高三下学期热身考试化学试题
名校
2 . 二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_________ 。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:___________ ;为避免产生上述污染,请提出一种解决方案:_______________________________ 。
(3)“萃取”时存在反应:Ce4++n(HA)2 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____ ;下图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=c[Ce•(H2n-4A2n)]/c(CeSO42+))。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:___________ 。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作__________ (填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为_________ 。
(5)“氧化”步骤的化学方程式为:_____________________________ 。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_____ 。

已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:
(3)“萃取”时存在反应:Ce4++n(HA)2
 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作
(5)“氧化”步骤的化学方程式为:
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为
您最近一年使用:0次
2017-02-17更新
|
879次组卷
|
3卷引用:2016-2017学年安徽省淮北市第一中学高二下学期第一次月考化学试卷
13-14高三·广东深圳·阶段练习
名校
3 . 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。

(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。①此时装置C中产生的现象是______ 。
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为______ 。
(2)接下来使Cu完全溶解的操作是:
① 拆除C、D装置后,打开弹簧夹
②______
(3)为使A中固体加快溶解速率,以下方法运用合理的是______ 。
a.对A装置加热;b.向A内加入少量Fe2O3;c.向A内加入少量CuO;d.增大空气通入量;e.向A内加入少量FeSO4;f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液。
①此过程的离子反应方程式是______ 。
②检验溶液中铁元素是否被完全沉淀最好的方法是______
a.取样于试管→滴加KSCN溶液
b.取样于试管→滴加酸性KMnO4溶液
c.取样于试管→纸上层析后→ 喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为:______ 。

(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。①此时装置C中产生的现象是
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为
(2)接下来使Cu完全溶解的操作是:
① 拆除C、D装置后,打开弹簧夹
②
(3)为使A中固体加快溶解速率,以下方法运用合理的是
a.对A装置加热;b.向A内加入少量Fe2O3;c.向A内加入少量CuO;d.增大空气通入量;e.向A内加入少量FeSO4;f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液。
①此过程的离子反应方程式是
②检验溶液中铁元素是否被完全沉淀最好的方法是
a.取样于试管→滴加KSCN溶液
b.取样于试管→滴加酸性KMnO4溶液
c.取样于试管→纸上层析后→ 喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为:
您最近一年使用:0次



