名校
解题方法
1 . 将1.76g镁铜合金投入20mL一定浓度的硝酸中,合金完全溶解,产生NO和NO2混合气体896mL(不考虑其他气体,体积折算为标准状况下),反应结束后向溶液中加入120mL1mol·L-1NaOH溶液,恰好使溶液中的金属阳离子全部转化为沉淀3.12g。若将盛有896mL该混合气体的容器倒扣在水中,通入一定体积的氧气,恰好可将该混合气体完全转化。下列说法错误的是
| A.Mg与Cu的物质的量比值为3:1 | B.NO和NO2的体积比为1:1 |
| C.原硝酸的浓度为8mol·L-1 | D.通入的O2的体积(标准状况下)V=448mL |
您最近一年使用:0次
2024-04-06更新
|
382次组卷
|
2卷引用:安徽省淮北市第一中学2023-2024学年高一下学期3月月考化学试题
解题方法
2 . 为了减缓温室效应,实现碳中和目标,可将 转化为甲醚、甲醇等产品.请回答问题:
转化为甲醚、甲醇等产品.请回答问题:
 与
与 制甲醚
制甲醚 的主要反应如下:
的主要反应如下:
I.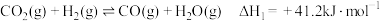
Ⅱ.
Ⅲ.
(1)总反应 的
的
__________ .
(2)若在体积恒定的密闭容器内发生上述反应,下列措施可提高总反应速率的是_________ .
a.加入催化剂 b.降低温度 c.充入惰性气体 d.同比例的增大 和
和 的投料
的投料
(3)密闭容器中充入 ,在
,在 条件下测得平衡时
条件下测得平衡时 转化率和
转化率和 选择性随温度的变化如图所示.
选择性随温度的变化如图所示. 选择性
选择性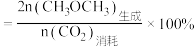
①表示 选择性的是曲线
选择性的是曲线___________ 填(“M”或“N”);
②温度高于 时,曲线N随温度升高而升高的原因是
时,曲线N随温度升高而升高的原因是_____________ ;
③为同时提高平衡时 转化率和
转化率和 选择性,应选择的反应条件为
选择性,应选择的反应条件为________ (填字母)
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
④Q点温度下 的物质的量为
的物质的量为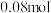 ,则该温度下反应Ⅲ的
,则该温度下反应Ⅲ的
________ .
(4)研究发现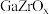 双金属氧化物对
双金属氧化物对 加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是
加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是__________ .
c.整个过程中, 元素的化合价未发生变化 d.机理图上中间体有三种
元素的化合价未发生变化 d.机理图上中间体有三种
 转化为甲醚、甲醇等产品.请回答问题:
转化为甲醚、甲醇等产品.请回答问题: 与
与 制甲醚
制甲醚 的主要反应如下:
的主要反应如下:I.
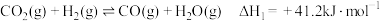
Ⅱ.

Ⅲ.

(1)总反应
 的
的
(2)若在体积恒定的密闭容器内发生上述反应,下列措施可提高总反应速率的是
a.加入催化剂 b.降低温度 c.充入惰性气体 d.同比例的增大
 和
和 的投料
的投料(3)密闭容器中充入
 ,在
,在 条件下测得平衡时
条件下测得平衡时 转化率和
转化率和 选择性随温度的变化如图所示.
选择性随温度的变化如图所示.
 选择性
选择性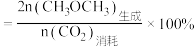
①表示
 选择性的是曲线
选择性的是曲线②温度高于
 时,曲线N随温度升高而升高的原因是
时,曲线N随温度升高而升高的原因是③为同时提高平衡时
 转化率和
转化率和 选择性,应选择的反应条件为
选择性,应选择的反应条件为a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
④Q点温度下
 的物质的量为
的物质的量为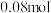 ,则该温度下反应Ⅲ的
,则该温度下反应Ⅲ的
(4)研究发现
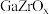 双金属氧化物对
双金属氧化物对 加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是
加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是

c.整个过程中,
 元素的化合价未发生变化 d.机理图上中间体有三种
元素的化合价未发生变化 d.机理图上中间体有三种
您最近一年使用:0次
解题方法
3 . 铌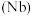 、钽
、钽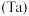 为同族元素,在航空航天、武器装备等领域发挥着重要作用.以含铌、钽的尾矿(主要成分
为同族元素,在航空航天、武器装备等领域发挥着重要作用.以含铌、钽的尾矿(主要成分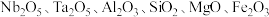 等)为原料制备
等)为原料制备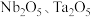 的工艺流程如下:
的工艺流程如下: ;
; 。
。
②“转化”步骤中 分别转化成氟铌酸根
分别转化成氟铌酸根 、氟钽酸根
、氟钽酸根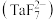 。
。
回答下列问题:
(1)“滤液1”中的主要成分为_______________________ (填化学式);
(2)“盐酸预洗”的目的是_______________________ ;
(3)①“转化”步骤中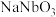 转化为
转化为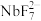 的离子方程式为
的离子方程式为_______________________ ;
②“转化”步骤在 、硫酸酸化下完成,反应速率方程为:
、硫酸酸化下完成,反应速率方程为: .
. 的作用是
的作用是_______________________ ;不能用盐酸代替 的理由是:
的理由是:_______________________ ;
(4)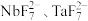 能被不同的有机溶剂选择性地萃取而与杂质分离,水相1和水相2中加入硫酸可以回收利用
能被不同的有机溶剂选择性地萃取而与杂质分离,水相1和水相2中加入硫酸可以回收利用________ (填化学式),“调节 ”步骤得到的沉淀是铌、钽的氢氧化物,煅烧氢氧化钽发生的反应方程式为
”步骤得到的沉淀是铌、钽的氢氧化物,煅烧氢氧化钽发生的反应方程式为_________ 。
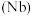 、钽
、钽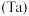 为同族元素,在航空航天、武器装备等领域发挥着重要作用.以含铌、钽的尾矿(主要成分
为同族元素,在航空航天、武器装备等领域发挥着重要作用.以含铌、钽的尾矿(主要成分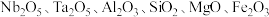 等)为原料制备
等)为原料制备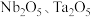 的工艺流程如下:
的工艺流程如下: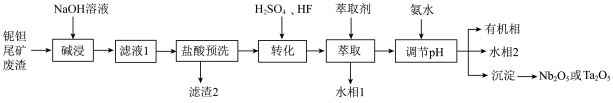
 ;
; 。
。②“转化”步骤中
 分别转化成氟铌酸根
分别转化成氟铌酸根 、氟钽酸根
、氟钽酸根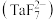 。
。回答下列问题:
(1)“滤液1”中的主要成分为
(2)“盐酸预洗”的目的是
(3)①“转化”步骤中
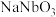 转化为
转化为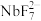 的离子方程式为
的离子方程式为②“转化”步骤在
 、硫酸酸化下完成,反应速率方程为:
、硫酸酸化下完成,反应速率方程为: .
. 的作用是
的作用是 的理由是:
的理由是:(4)
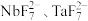 能被不同的有机溶剂选择性地萃取而与杂质分离,水相1和水相2中加入硫酸可以回收利用
能被不同的有机溶剂选择性地萃取而与杂质分离,水相1和水相2中加入硫酸可以回收利用 ”步骤得到的沉淀是铌、钽的氢氧化物,煅烧氢氧化钽发生的反应方程式为
”步骤得到的沉淀是铌、钽的氢氧化物,煅烧氢氧化钽发生的反应方程式为
您最近一年使用:0次
4 . 向 溶液中滴加
溶液中滴加 溶液,
溶液, 的百分含量
的百分含量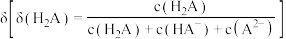 随溶液
随溶液 的变化如图所示:
的变化如图所示:
 溶液中滴加
溶液中滴加 溶液,
溶液, 的百分含量
的百分含量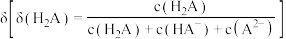 随溶液
随溶液 的变化如图所示:
的变化如图所示:
A. 的数量级为 的数量级为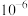 | B.a点对应的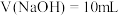 |
C.b点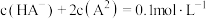 | D.c点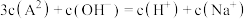 |
您最近一年使用:0次
2024-03-26更新
|
150次组卷
|
3卷引用:安徽省淮北市2024届高三第一次质量检测(一模)化学试题
名校
解题方法
5 . 室温下,用含有少量 的
的 溶液制备
溶液制备 的过程如下。下列说法正确的是
的过程如下。下列说法正确的是
 的
的 溶液制备
溶液制备 的过程如下。下列说法正确的是
的过程如下。下列说法正确的是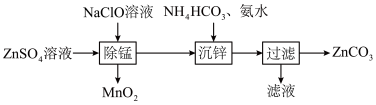
A. 溶液中: 溶液中: |
B. 溶液中: 溶液中: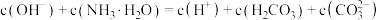 |
C.“过滤”所得滤液中: |
D.“过滤”所得滤液中: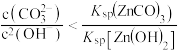 |
您最近一年使用:0次
2024-02-13更新
|
897次组卷
|
5卷引用:安徽省淮北市第一中学2023-2024学年高二下学期第一次月考化学试题
安徽省淮北市第一中学2023-2024学年高二下学期第一次月考化学试题江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)化学(江苏卷02)-2024年高考押题预测卷江苏省无锡市锡东高级中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
6 . 某小组为探究 (三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。

(1)在实验进行的过程中,应该持续通入氮气的目的是___________ 。
(2)若实验中观察装置F中澄清石灰水变浑浊,装置E中固体变为红色,则说明 的热分解产物中一定含有
的热分解产物中一定含有___________ 。
(3)该样品完全热分解后,欲检测固体生成物中的组成,某同学待装置冷却后取少量固体加入稀硫酸溶解,再加入 溶液变红,说明
溶液变红,说明___________ 。
(4)已知: 是一种光敏化合物,见光分解。该实验小组在探究
是一种光敏化合物,见光分解。该实验小组在探究 热分解后,用该装置再次探究它光解的产物,现取
热分解后,用该装置再次探究它光解的产物,现取 固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
完成下列小题:
①若反应后 元素的化合价降为
元素的化合价降为 价,K元素的化合价未改变,且两者仍为草酸
价,K元素的化合价未改变,且两者仍为草酸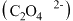 盐,写出三草酸合铁酸钾完全光解的化学方程式
盐,写出三草酸合铁酸钾完全光解的化学方程式___________ 。
②据此计算出该 固体的纯度为
固体的纯度为___________ (保留一位有效数字) 。
③样品完全分解后,实验小组停止通氮气,一段时间后,某同学取少许装置A中的残留物于试管中,加入稀硫酸溶解,滴入1~2滴 溶液,发现溶液变红,这与上述
溶液,发现溶液变红,这与上述 分解产物为
分解产物为 价
价 的结论不符可能的原因是
的结论不符可能的原因是___________ 。
 (三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(1)在实验进行的过程中,应该持续通入氮气的目的是
(2)若实验中观察装置F中澄清石灰水变浑浊,装置E中固体变为红色,则说明
 的热分解产物中一定含有
的热分解产物中一定含有(3)该样品完全热分解后,欲检测固体生成物中的组成,某同学待装置冷却后取少量固体加入稀硫酸溶解,再加入
 溶液变红,说明
溶液变红,说明(4)已知:
 是一种光敏化合物,见光分解。该实验小组在探究
是一种光敏化合物,见光分解。该实验小组在探究 热分解后,用该装置再次探究它光解的产物,现取
热分解后,用该装置再次探究它光解的产物,现取 固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。完成下列小题:
①若反应后
 元素的化合价降为
元素的化合价降为 价,K元素的化合价未改变,且两者仍为草酸
价,K元素的化合价未改变,且两者仍为草酸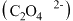 盐,写出三草酸合铁酸钾完全光解的化学方程式
盐,写出三草酸合铁酸钾完全光解的化学方程式②据此计算出该
 固体的纯度为
固体的纯度为③样品完全分解后,实验小组停止通氮气,一段时间后,某同学取少许装置A中的残留物于试管中,加入稀硫酸溶解,滴入1~2滴
 溶液,发现溶液变红,这与上述
溶液,发现溶液变红,这与上述 分解产物为
分解产物为 价
价 的结论不符可能的原因是
的结论不符可能的原因是
您最近一年使用:0次
名校
解题方法
7 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。资料i. 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色);ⅱ.浓碱条件下,
(紫色);ⅱ.浓碱条件下, 可被
可被 还原为
还原为 ;ⅲ.
;ⅲ. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)。
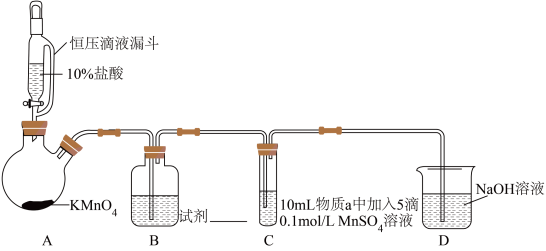
(1)B中试剂是___________ 。
(2)通 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为___________ 。
(3)对比实验I、Ⅱ通 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是___________ 。
(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:________ 。但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为________ ,溶液绿色缓慢加深,原因是 被
被________ (填化学式)氧化,可证明Ⅲ中的悬浊液中氧化剂过量。
③取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入 水,溶液紫色缓慢加深,发生的反应是
水,溶液紫色缓慢加深,发生的反应是________ 。
 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色);ⅱ.浓碱条件下,
(紫色);ⅱ.浓碱条件下, 可被
可被 还原为
还原为 ;ⅲ.
;ⅲ. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。实验装置如图(夹持装置略)。

| 序号 | 物质a | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ |  溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ |  溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)B中试剂是
(2)通
 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为(3)对比实验I、Ⅱ通
 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入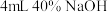 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 被
被③取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入 水,溶液紫色缓慢加深,发生的反应是
水,溶液紫色缓慢加深,发生的反应是
您最近一年使用:0次
2024-01-29更新
|
108次组卷
|
2卷引用:安徽省淮北市第一中学2023-2024学年高一上学期1月阶段性调研化学试题
名校
解题方法
8 . 金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,·些水管的活塞会“自动”熔化,喷出水来。由一种铋矿[主要成分为 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
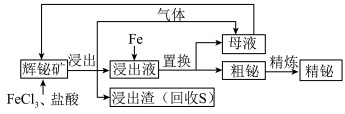
已知:酸性条件下的氧化性: 。
。
(1)“浸出”过程中,溶液中放出的气体是_________ ;放出该气体的离子方程式是________ 。
(2)加入 溶液的目的是
溶液的目的是___________ ,该反应的离子方程式是___________ 。
(3)检验母液中所含有的主要金属阳离子的方法是___________ 。
(4)铋的+5价盐类( 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:
据图回答下面的问题:
①上述试剂的氧化性强弱顺序为:___________ 。
②写出 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向_________ ,已知 不溶于水。)
不溶于水。)
 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
已知:酸性条件下的氧化性:
 。
。(1)“浸出”过程中,溶液中放出的气体是
(2)加入
 溶液的目的是
溶液的目的是(3)检验母液中所含有的主要金属阳离子的方法是
(4)铋的+5价盐类(
 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:| 加入溶液 | ①适量铋酸钠固体 | ②过量的双氧水 | ③加入淀粉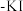 溶液 溶液 |
| 实验现象 | 溶液呈现紫红色 | 紫红色消失,产生气泡 | 溶液变为蓝色 |
①上述试剂的氧化性强弱顺序为:
②写出
 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向 不溶于水。)
不溶于水。)
您最近一年使用:0次
名校
解题方法
9 . 硫酸有着广泛的用途。硫酸工业在国民经济中占有重要地位。
(1)实验室可用铜与浓硫酸反应制备少量 :
: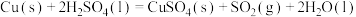
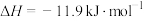 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
(2)我国古籍记载了硫酸的制备方法—“炼石胆( )取精华法”。
)取精华法”。
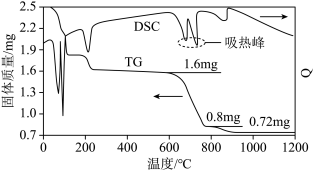
①借助现代仪器分析,该制备过程中 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有___________ 、___________ (填化学式)和 。
。
②已知下列热化学方程式:
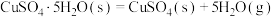



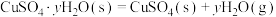

则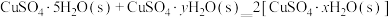 的△H=
的△H=__________  。
。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化: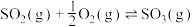
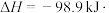

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率( )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是__________ 。
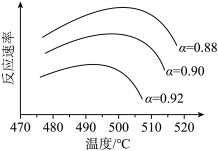
A.温度越高,反应速率越大 B.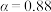 的曲线代表平衡转化率
的曲线代表平衡转化率
C. 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度
②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=__________ 。
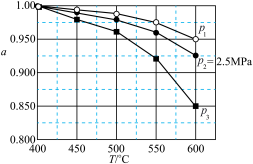
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为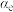 ,则上述催化氧化反应
,则上述催化氧化反应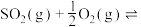
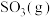 的
的
_____________ (用含p和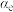 的代数式表示)。
的代数式表示)。
(1)实验室可用铜与浓硫酸反应制备少量
 :
: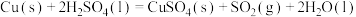
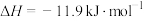 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)我国古籍记载了硫酸的制备方法—“炼石胆(
 )取精华法”。
)取精华法”。①借助现代仪器分析,该制备过程中
 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有 。
。
②已知下列热化学方程式:
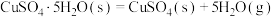



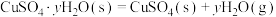

则
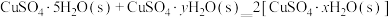 的△H=
的△H= 。
。(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: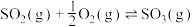
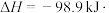

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率(
 )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
A.温度越高,反应速率越大 B.
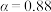 的曲线代表平衡转化率
的曲线代表平衡转化率C.
 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到
 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数
 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为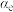 ,则上述催化氧化反应
,则上述催化氧化反应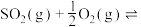
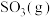 的
的
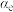 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
10 . T℃时,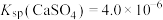 、
、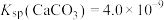 、
、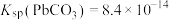 ,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是

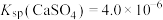 、
、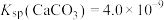 、
、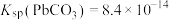 ,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
A.c线是 沉淀溶解平衡曲线 沉淀溶解平衡曲线 |
B.T℃时,向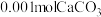 沉淀中加入 沉淀中加入 溶液(反应后溶液为1L),使 溶液(反应后溶液为1L),使 沉淀会转化为 沉淀会转化为 沉淀,所需 沉淀,所需 的物质的量至少为1.001mol 的物质的量至少为1.001mol |
C.T℃时,向10mL水中加入 和 和 至二者均饱和,溶液中 至二者均饱和,溶液中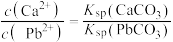 |
D.若d点表示 的饱和溶液加入 的饱和溶液加入 饱和溶液等体积混合则: 饱和溶液等体积混合则: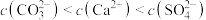 |
您最近一年使用:0次
2023-12-02更新
|
451次组卷
|
3卷引用:安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题
安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题浙江省台州市山海协作体2023-2024学年高二上学期期中联考化学试题(已下线)寒假作业07 沉淀溶解平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)



