1 . 如图是氮元素的几种化合价与物质类别的对应关系:
(1)写出N2的一种用途:___ 。
(2)从氮元素化合价分析,N2具有氧化性和还原性。写出氮气表现氧化性的一个化学方程式:__ 。
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为___ 。
(4)实验室制取物质B的化学方程式为___ 。
(5)NO2与水反应生成物质A的化学方程式为___ 。
(6)浓硝酸与木炭在加热条件下反应的化学方程式为___ 。

(1)写出N2的一种用途:
(2)从氮元素化合价分析,N2具有氧化性和还原性。写出氮气表现氧化性的一个化学方程式:
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为
(4)实验室制取物质B的化学方程式为
(5)NO2与水反应生成物质A的化学方程式为
(6)浓硝酸与木炭在加热条件下反应的化学方程式为
您最近一年使用:0次
2020-09-23更新
|
1453次组卷
|
4卷引用:高一必修第一册(鲁科2019)第3章 章末综合检测卷
名校
2 . 下列有关物质的性质与用途的叙述中,二者不具有 对应关系的是
| A.NH3易溶于水,可用作制冷剂 |
| B.SO2具有漂白性,可用来漂白纸浆 |
| C.浓硫酸具有吸水性,可用作干燥剂 |
| D.漂白粉具有氧化性,可用作环境消毒剂 |
您最近一年使用:0次
2019-02-19更新
|
930次组卷
|
5卷引用:沪科版高中化学二单元《 开发海水中的卤素资源》单元检测题1
名校
解题方法
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。______ (填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________ 。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl−和NO3-,其离子方程式为______________________________________ 。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________ 。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________ 。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________ 。

(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为
(4)W的稀溶液与铜单质发生反应的离子方程式为
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为
您最近一年使用:0次
2020-01-09更新
|
510次组卷
|
7卷引用:专题7 本专题达标检测-高中化学必修第二册苏教版2019
名校
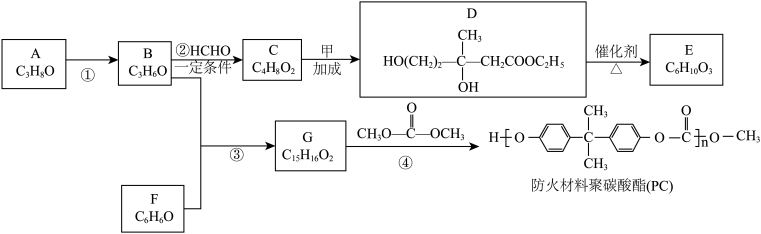
4 . A为重要的有机化工原料,B分子的核磁共振氢谱图中只有一个吸收峰,下列是合成防火材料聚碳酸酯(PC)和有广泛用途的内酯 的路线:
的路线:
已知:i: (
(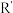 、
、 为氢原子或烃基)
为氢原子或烃基)
ii: (R、
(R、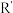 、
、 代表烃基)
代表烃基)
请回答下列问题:
(1)A的名称为___________ 。
(2)反应①的反应类型为___________ 。
(3)C分子含有的官能团是___________ 。
(4)化合物甲的分子式为___________ 。
(5)反应④的方程式为___________ 。
(6)E分子内含有六元环,可发生水解反应,其结构简式是___________ 。
(7)X是 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 的结构简式是
的结构简式是___________ 。
①
 能与足量银氨溶液生成
能与足量银氨溶液生成
 ;
;
② 中核磁共振氢谱中出现3组吸收峰,峰面积比为
中核磁共振氢谱中出现3组吸收峰,峰面积比为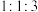 。
。
(8)以物质B为原料选用必要的无机试剂经过以下3步反应合成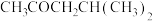 。
。
B CH3OCH2CH(CH3)2
CH3OCH2CH(CH3)2
写出中间产物1和中间产物2的结构简式:中间产物1_______ 、中间产物2________ 。
 的路线:
的路线:
已知:i:
 (
( 、
、 为氢原子或烃基)
为氢原子或烃基)ii:
 (R、
(R、 、
、 代表烃基)
代表烃基)请回答下列问题:
(1)A的名称为
(2)反应①的反应类型为
(3)C分子含有的官能团是
(4)化合物甲的分子式为
(5)反应④的方程式为
(6)E分子内含有六元环,可发生水解反应,其结构简式是
(7)X是
 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 的结构简式是
的结构简式是①

 能与足量银氨溶液生成
能与足量银氨溶液生成
 ;
;②
 中核磁共振氢谱中出现3组吸收峰,峰面积比为
中核磁共振氢谱中出现3组吸收峰,峰面积比为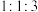 。
。(8)以物质B为原料选用必要的无机试剂经过以下3步反应合成
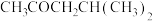 。
。B
 CH3OCH2CH(CH3)2
CH3OCH2CH(CH3)2写出中间产物1和中间产物2的结构简式:中间产物1
您最近一年使用:0次
名校
5 . 下列有关物质的用途说法不正确的是
| A.过氧化钠——漂白剂 |
| B.次氯酸钠——消毒剂 |
| C.纯碱——治疗胃酸过多 |
| D.小苏打——制作馒头和面包的膨松剂 |
您最近一年使用:0次
2022-08-06更新
|
648次组卷
|
27卷引用:第一章章末检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)
第一章章末检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)沪科版高中化学二单元《 开发海水中的卤素资源》单元检测题1(已下线)第一章 认识化学科学(基础过关)-2020-2021学年高一化学上学期必修第一册《单元测试定心卷》 (鲁科版2019)福建省平潭县新世纪学校2019-2020学年高二上学期第一次月考化学试题海南省临高县临高中学2019-2020学年高一上学期期中考试化学试题云南省通海三中2019-2020学年高一上学期期末考试化学试题(已下线)第一章章末检测(2)——《高中新教材同步备课》(鲁科版 必修第一册)福建省连城县第一中学2020-2021学年高一上学期月考(一)化学试题湖北生松滋市言程中学2020-2021学年高一上学期10月月考化学试题天津市静海区瀛海学校2020-2021学年高一上学期11月联考化学试题山东省济南市第一中学2020-2021学年高一上学期期中考试化学试题山东省泰安市宁阳一中2020-2021学年高一上学期第一次阶段性考试化学试题安徽省合肥瑶海区合肥市第十一中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP412】【化学】(已下线)【浙江新东方】73.安徽省六安市舒城育才学校2020-2021学年高一12月月考化学试题长春市第二十九中学2020-2021学年高一期末考试化学(理)试题长春市第二十九中学2020-2021学年高一期末考试化学(文)试题湖南省湘潭市第一中学2020-2021学年高一上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高一上学期模块考试(期中)化学试题浙江省东阳中学2021-2022学年高一上学期1月份考试化学试题山东省济宁市泗水县2021-2022学年高一上学期期中考试化学试题福建省华安县第一中学2022-2023学年高一上学期第二次月考化学试题安徽省安庆市白泽湖中学2021-2022学年高一上学期期中考试化学试题江西省南昌市知行中学2021-2022学年高一上学期期中化学试题湖南省郴州市苏仙区多校2022-2023学年高一上学期期末线上联考化学试题 山东省曹县第一中学2023-2024学年高一上学期10月月考化学试题
6 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是______ 。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为______ 。
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于______ (填字母代号)。
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:______ ;能使该反应发生的可能原因是______ 。
II.已知: 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色
在溶液中为黄色
(1)下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①基态Cr原子外围电子排布图为______ ;配合物[Cr(H2O)6]3+中与Cr3+形成配位键的原子是______ (填元素符号)。
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为______ 。
(2)有下列实验:
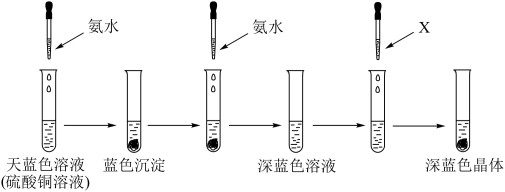
①呈天蓝色的离子的化学式为______ ,溶剂X可以是______ (填名称),继续添加氨水,沉淀溶解的离子方程式为______ 。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是______ 。
③下列有关化学实验的“操作→现象→解释”均正确的是______ 。
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:
II.已知:
 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色
在溶液中为黄色(1)下列反应曾用于检测司机是否酒后驾驶:2
 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH①基态Cr原子外围电子排布图为
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为
(2)有下列实验:

①呈天蓝色的离子的化学式为
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是
③下列有关化学实验的“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | Fe3++3SCN-=Fe(SCN)3↓ |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知Cr3+的配位数为6,则 CrCl3·6H2O的化学式可表示为[Cr(H2O)5Cl]Cl2·H2O |
| C | 向溶液K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH | 溶液先橙色加深,后变为黄 色 | 溶液中存在 +H2O⇌2 +H2O⇌2 +2H+ +2H+ |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近一年使用:0次
名校
7 . 钠及其化合物在化工生产和日常生活中都有广泛的用途。
Ⅰ.目前,世界多数国家采用电解熔融氯化钠的方法来生产金属钠: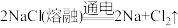 。已知物质A、B、C、D、E、F、G有如图转化关系(部分反应条件及产物已省略):
。已知物质A、B、C、D、E、F、G有如图转化关系(部分反应条件及产物已省略):

(1)写出上述转化关系中对应物质的化学式:D_______ ,E_______ 。
(2)写出物质A、B在加热条件下发生反应②的实验现象:_______ 。
(3)写出在水溶液中进行反应⑦的离子方程式为_______ 。
(4)若把物质A投入到D的水溶液中,该过程所发生反应的离子方程式为(若为分步反应则分步写离子方程式)_______
Ⅱ.部分碳酸盐是家庭常用食品膨松剂,例如蒸馒头过程中,面团在微生物作用下发酵时产生 气体,从而变得疏松,但同时也会产生一些有机弱酸,这时需要加入纯碱调节酸性。
气体,从而变得疏松,但同时也会产生一些有机弱酸,这时需要加入纯碱调节酸性。
(5)下列关于纯碱的认识正确的是_______ 。
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(6)探究用 调节面团酸度,而不用
调节面团酸度,而不用 的原因。取质量均为1g的
的原因。取质量均为1g的 与
与 分别与足量酸反应生成
分别与足量酸反应生成 时,消耗
时,消耗 的量更多的是
的量更多的是_______ (填化学式)。
(7)如果面团发酵得不好,气孔少且略有酸味,可改用 替代纯碱。此时
替代纯碱。此时 的作用有(请用化学方程式结合文字表述)
的作用有(请用化学方程式结合文字表述)_______ 。
Ⅰ.目前,世界多数国家采用电解熔融氯化钠的方法来生产金属钠:
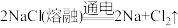 。已知物质A、B、C、D、E、F、G有如图转化关系(部分反应条件及产物已省略):
。已知物质A、B、C、D、E、F、G有如图转化关系(部分反应条件及产物已省略):
(1)写出上述转化关系中对应物质的化学式:D
(2)写出物质A、B在加热条件下发生反应②的实验现象:
(3)写出在水溶液中进行反应⑦的离子方程式为
(4)若把物质A投入到D的水溶液中,该过程所发生反应的离子方程式为(若为分步反应则分步写离子方程式)
Ⅱ.部分碳酸盐是家庭常用食品膨松剂,例如蒸馒头过程中,面团在微生物作用下发酵时产生
 气体,从而变得疏松,但同时也会产生一些有机弱酸,这时需要加入纯碱调节酸性。
气体,从而变得疏松,但同时也会产生一些有机弱酸,这时需要加入纯碱调节酸性。(5)下列关于纯碱的认识正确的是
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(6)探究用
 调节面团酸度,而不用
调节面团酸度,而不用 的原因。取质量均为1g的
的原因。取质量均为1g的 与
与 分别与足量酸反应生成
分别与足量酸反应生成 时,消耗
时,消耗 的量更多的是
的量更多的是(7)如果面团发酵得不好,气孔少且略有酸味,可改用
 替代纯碱。此时
替代纯碱。此时 的作用有(请用化学方程式结合文字表述)
的作用有(请用化学方程式结合文字表述)
您最近一年使用:0次
2021-03-22更新
|
1051次组卷
|
3卷引用:第二章 海水中的重要元素——钠和氯(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
(已下线)第二章 海水中的重要元素——钠和氯(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)河北省石家庄市第二中学2020-2021学年高一上学期期中考试化学试卷广东省广州市真光中学2022-2023学年高一上学期期中考化学试题
8 . 我国科学家在1965年9月首先用人工方法合成牛胰岛素。为了证实人工合成的胰岛素与天然的是否是同一物质,在人工合成牛胰岛素过程中掺入了放射性14C,然后将人工合成的牛胰岛素与天然的混合得到了放射性14C分布均匀的结晶物,从而证明了两者都是同一种物质,为我国在国际上首先合成具有生物活性牛胰岛素提供了有力证据。
1. 在人工合成过程中掺入放射性14C的用途是____
A. 催化剂 B. 媒介质 C. 组成元素 D. 示踪原子
2. 以上所述人工合成的牛胰岛素与天然结晶的是同一物质的依据是____
A. 扩散作用 B. 渗透作用 C. 相似相溶原理 D. 物质结构相同
3. 人工合成牛胰岛素,证明了下列哪个过程是可能的____
A. 从无机小分子转化为有机小分子 B. 从有机小分子转化为有机高分子
C. 从有机高分子转化为多分子体系 D. 从多分子体系演变为原始生命
4. 人造象牙的主要成分的结构简式是-[CH2-O-]n-,可通过加聚反应生成它的单体是____
A. (CH3)2O B. CH3CHO C. CH3OH D. HCHO
1. 在人工合成过程中掺入放射性14C的用途是
A. 催化剂 B. 媒介质 C. 组成元素 D. 示踪原子
2. 以上所述人工合成的牛胰岛素与天然结晶的是同一物质的依据是
A. 扩散作用 B. 渗透作用 C. 相似相溶原理 D. 物质结构相同
3. 人工合成牛胰岛素,证明了下列哪个过程是可能的
A. 从无机小分子转化为有机小分子 B. 从有机小分子转化为有机高分子
C. 从有机高分子转化为多分子体系 D. 从多分子体系演变为原始生命
4. 人造象牙的主要成分的结构简式是-[CH2-O-]n-,可通过加聚反应生成它的单体是
A. (CH3)2O B. CH3CHO C. CH3OH D. HCHO
您最近一年使用:0次
9 . 有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为____________ ,其晶体属于____________ 晶体。
(2)乙的水溶液可以用来做________________________ (写出一种用途)。
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则
①丁的电子式为_____ 。
②丁可由次氯酸钠与过量氨气反应制得,其化学方程式________________________ 。
甲的制备过程中氨气需要过量的理由是____________________________________ 。
③丁的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1丁水溶液的pH等于____________ (忽略丁的二级电离和H2O的电离)。
(1)甲的化学式为
(2)乙的水溶液可以用来做
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则
①丁的电子式为
②丁可由次氯酸钠与过量氨气反应制得,其化学方程式
甲的制备过程中氨气需要过量的理由是
③丁的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1丁水溶液的pH等于
您最近一年使用:0次
2019-09-06更新
|
249次组卷
|
2卷引用:沪科版高中化学二单元《 开发海水中的卤素资源》单元检测题1
10 . 乳酸最初就是从酸牛奶中得到并由此而得名的。近年来,乳酸成为研究热点之一。利用乳酸 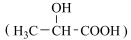 为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
(2)乳酸发生下列变化: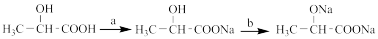
(3)乳酸在浓硫酸作用下,两分子相互反应生成环状结构的物质,写出此生成物的结构简式
(4)请写出乳酸与乙醇反应的化学方程式
(5)乳酸聚合成的纤维非常适合做手术缝合线,其原因是
您最近一年使用:0次



