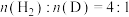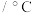1 . 下列物质的性质与用途均正确且具有对应关系的是
| A.甲醛易溶于水,可用作防腐剂 | B. 具有弱酸性,可用作漂白剂 具有弱酸性,可用作漂白剂 |
C. 具有挥发性,可用于溶解银 具有挥发性,可用于溶解银 | D. 性质稳定,可用作食品的保护气 性质稳定,可用作食品的保护气 |
您最近一年使用:0次
2024-04-19更新
|
110次组卷
|
2卷引用:甘肃省2024届高三普通高中三模化学试卷
解题方法
2 . 一定温度和压强下,CO2可转化为具有良好溶解能力和流动性能的超临界流体。C2H2在氧气中燃烧放出大量的热,常用来切割金属。下列物质结构与性质或物质性质与用途不具有对应关系的是
| A.干冰中CO2分子间的范德华力较弱,CO2具有较好的热稳定性 |
| B.金刚石具有很高的硬度,可用作地质钻探钻头 |
| C.石墨中碳原子未参与杂化的2p电子可在整个碳原子平面中运动,石墨具有导电性 |
| D. CO2是非极性分子,超临界CO2流体可用于萃取物料中的低极性组分 |
您最近一年使用:0次
3 . 下列有关物质的性质与用途具有对应关系的是
| A.铝的金属活泼性强,可用于制作铝金属制品 |
| B.氧化铝熔点高,可用作电解冶炼铝的原料 |
| C.氢氧化铝受热分解,可用于中和过多的胃酸 |
| D.明矾溶于水并水解形成胶体,可用于净水 |
您最近一年使用:0次
2020-07-11更新
|
7086次组卷
|
47卷引用:上海市崇明区2021届高三下学期二模化学试题
上海市崇明区2021届高三下学期二模化学试题(已下线)2020年江苏卷化学高考真题变式题1-102020年江苏卷化学高考试题(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编(已下线)第5单元 常见的金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第12讲 镁、铝、铜及其化合物 金属冶炼(精讲)——2021年高考化学一轮复习讲练测四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题黑龙江省哈尔滨市第九中学2021届高三上学期开学考试化学试题(已下线)小题必刷14 铝及其化合物——2021年高考化学一轮复习小题必刷(通用版)河南省三门峡市第一高级中学2021届高三8月开学考试化学试题江西师范大学附属中学2020-2021学年高一上学期12月考试化学试题(已下线)练习12 从铝土矿到铝合金-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)河南省豫南九校2020-2021学年高一上学期第三次联考化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时16 铝及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向03 物质的组成、性质和分类-备战2022年高考化学一轮复习考点微专题(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第8讲 金属材料(不锈钢、铝合金、合金)(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)江西省赣州市第十四中学2022届高三上学期第二次月考化学试题(已下线)第三单元 金属及其化合物(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)北京市北京中国人民大学附属中学2022届高三10月检测化学试卷(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)第5章 金属及其化合物(章末复习)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省鹤岗市第一中学2021-2022学年高二下学期期末考试化学试题第三章 铁金属材料 综合拔高练(已下线)第08讲 金属材料(讲)-2023年高考化学一轮复习讲练测(新教材新高考)甘肃省武威第十八中学2022-2023学年高三上学期第一次诊断化学试题江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题内蒙古巴彦淖尔市临河区第三中学2021~2022学年高三上学期期中考试化学试题(已下线)专题08 元素及其化合物(练)-2023年高考化学二轮复习讲练测(新高考专用)北京市昌平区第二中学2022-2023 学年高三上学期期中考试化学试题(已下线)专题09 常见金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第三章 金属及其化合物 第15讲 金属材料 金属冶炼(已下线)题型33 铝及其化合物的性质(已下线)专题05 元素化合物性质(已下线)第5讲 金属材料与金属的冶炼(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题1-5陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷江苏省扬州大学附属中学2023-2024学年高二下学期 3月月考化学试卷广东省河源市龙川县第一中学2023-2024学年高二下学期期中考试化学试题
4 . 甘氨酸(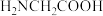 )是一种最简单的氨基酸。其作为内源性抗氧化剂还原型谷胱甘肽的组成氨基酸,在机体发生严重应激时常需外源补充。如图为某兴趣小组通过实验获得在25℃下10mL
)是一种最简单的氨基酸。其作为内源性抗氧化剂还原型谷胱甘肽的组成氨基酸,在机体发生严重应激时常需外源补充。如图为某兴趣小组通过实验获得在25℃下10mL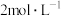 甘氨酸溶液中各组分分布分数和pH的对应关系(通过HCl调节pH,溶液体积不变)
甘氨酸溶液中各组分分布分数和pH的对应关系(通过HCl调节pH,溶液体积不变)
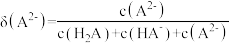
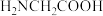 )是一种最简单的氨基酸。其作为内源性抗氧化剂还原型谷胱甘肽的组成氨基酸,在机体发生严重应激时常需外源补充。如图为某兴趣小组通过实验获得在25℃下10mL
)是一种最简单的氨基酸。其作为内源性抗氧化剂还原型谷胱甘肽的组成氨基酸,在机体发生严重应激时常需外源补充。如图为某兴趣小组通过实验获得在25℃下10mL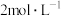 甘氨酸溶液中各组分分布分数和pH的对应关系(通过HCl调节pH,溶液体积不变)
甘氨酸溶液中各组分分布分数和pH的对应关系(通过HCl调节pH,溶液体积不变)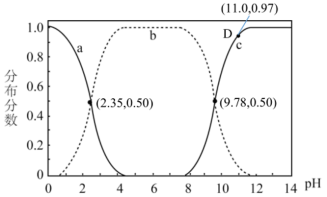
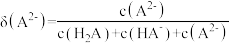
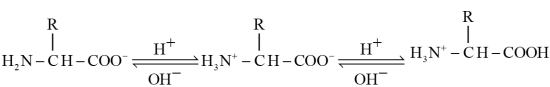
A.a为 ,b为 ,b为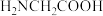 ,c为 ,c为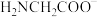 , , , , |
B. 时, 时, |
C.在D点溶液中: |
| D.该兴趣小组测得甘氨酸的pL=6.065,查表得知甘氨酸实际pL=5.97,造成误差的原因可能是因为原甘氨酸样品中有杂质,导致甘氨酸实际浓度偏低 |
您最近一年使用:0次
解题方法
5 . 钛被称为继铁、铝之后的第三金属。钙钛矿是一类氧化物陶瓷材料,典型代表是 晶体,是工业获取钛的重要原料。
晶体,是工业获取钛的重要原料。
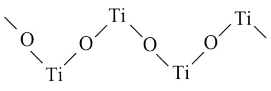
(1)基态钛原子的价层电子排布式为______ ,其原子核外共有______ 种运动状态不同的电子。
(2)六氟合钛酸钾(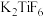 )中存在
)中存在 配离子,其中钛元素的化合价是
配离子,其中钛元素的化合价是______ ,配体是______ 。
(3)硫酸氧钛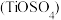 晶体中阳离子为链状聚合形式的离子,结构如图所示,则该阳离子的化学式为
晶体中阳离子为链状聚合形式的离子,结构如图所示,则该阳离子的化学式为______ ,阴离子中心原子的杂化轨道类型为______ 。
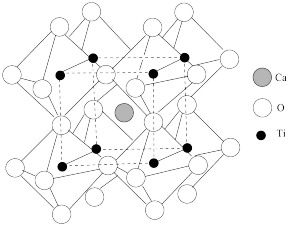
(4) 晶体结构如图,已知该晶体晶胞参数为anm,则与
晶体结构如图,已知该晶体晶胞参数为anm,则与 紧邻的O个数为
紧邻的O个数为______ ,O与O间的最短距离为______  。
。
(5)钨青铜( )是一类色彩丰富的非整比化合物,其晶体结构与上述
)是一类色彩丰富的非整比化合物,其晶体结构与上述 晶体结构相同,若
晶体结构相同,若 无空缺,化学式为
无空缺,化学式为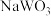 ,完全空缺则为
,完全空缺则为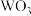 ,每填入1个
,每填入1个 ,相应有1个
,相应有1个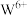 还原为
还原为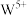 。
。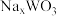 的颜色与x值的对应关系如图所示,已知某钨青铜晶体中
的颜色与x值的对应关系如图所示,已知某钨青铜晶体中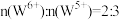 ,则其颜色为
,则其颜色为______ 色。
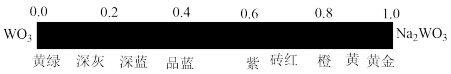
 晶体,是工业获取钛的重要原料。
晶体,是工业获取钛的重要原料。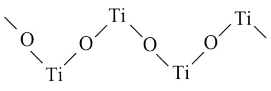
(1)基态钛原子的价层电子排布式为
(2)六氟合钛酸钾(
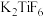 )中存在
)中存在 配离子,其中钛元素的化合价是
配离子,其中钛元素的化合价是(3)硫酸氧钛
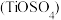 晶体中阳离子为链状聚合形式的离子,结构如图所示,则该阳离子的化学式为
晶体中阳离子为链状聚合形式的离子,结构如图所示,则该阳离子的化学式为(4)
 晶体结构如图,已知该晶体晶胞参数为anm,则与
晶体结构如图,已知该晶体晶胞参数为anm,则与 紧邻的O个数为
紧邻的O个数为 。
。
(5)钨青铜(
 )是一类色彩丰富的非整比化合物,其晶体结构与上述
)是一类色彩丰富的非整比化合物,其晶体结构与上述 晶体结构相同,若
晶体结构相同,若 无空缺,化学式为
无空缺,化学式为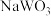 ,完全空缺则为
,完全空缺则为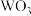 ,每填入1个
,每填入1个 ,相应有1个
,相应有1个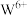 还原为
还原为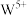 。
。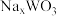 的颜色与x值的对应关系如图所示,已知某钨青铜晶体中
的颜色与x值的对应关系如图所示,已知某钨青铜晶体中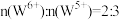 ,则其颜色为
,则其颜色为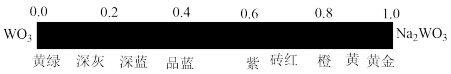
您最近一年使用:0次
名校
解题方法
6 . 二氧化铈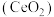 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与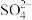 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)“氧化焙烧”中氧化的目的是___________ 。
(2)“酸浸”时提高浸取率的方法___________ (写出一种)。
(3)“萃取”时存在反应: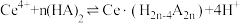 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为___________ (填标号);硫酸浓度过大时,萃取率降低的原因是___________ 。
(4)“反萃取”中,在稀硫酸和 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:___________ 。
(5)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于___________ 时, 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
(6)二氧化铈( )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物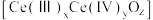 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为___________ ,当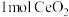 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为___________ 。
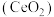 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 能与
能与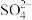 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)“氧化焙烧”中氧化的目的是
(2)“酸浸”时提高浸取率的方法
(3)“萃取”时存在反应:
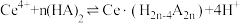 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
(4)“反萃取”中,在稀硫酸和
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(5)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)(6)二氧化铈(
 )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物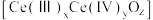 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为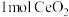 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为
您最近一年使用:0次
解题方法
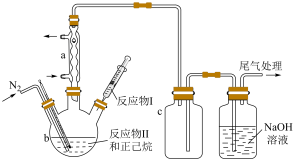
7 . 四乙氧基硅烷Si(OC2H5)4具有广泛工业用途。某小组用SiCl4和C2H5OH反应制备Si(OC2H5)4,并探究影响产率的因素。相关物质的沸点和水解性如下:
实验装置示意简图如图所示(加热及夹持装置略)。
(1)制备Si(OC2H5)4
①仪器a的名称是___________ ;c瓶的作用是___________ 。
②b中生成Si(OC2H5)4的化学方程式为___________ 。
③反应过程中有H2O和C2H5Cl生成,但混合物中未检出H2O的原因是___________ ;滤液质谱图中也无C2H5Cl的特征峰的原因是___________ 。
④当馏出液为产品时,蒸馏温度应控制在___________ ℃。
(2)影响产率的因素
①控制变量法可用于探究影响产率的因素,在设计实验时需要考虑的变量有___________ 。
A.反应温度 B.溶剂类型 C.加料顺序 D.滴加速率
②N2流速对产率也有影响,随着N2流速增大,产率先增大后减小,主要原因是___________ 。
| 物质 | SiCl4 | C2H5OH | Si(OC2H5)4 | 正己烷 | C2H5Cl |
| 沸点/℃ | 58 | 78 | 168 | 68 | 12 |
| 水解性 | 易水解 | — | 易水解 | 一 | — |
(1)制备Si(OC2H5)4
①仪器a的名称是
②b中生成Si(OC2H5)4的化学方程式为
③反应过程中有H2O和C2H5Cl生成,但混合物中未检出H2O的原因是
④当馏出液为产品时,蒸馏温度应控制在
(2)影响产率的因素
①控制变量法可用于探究影响产率的因素,在设计实验时需要考虑的变量有
A.反应温度 B.溶剂类型 C.加料顺序 D.滴加速率
②N2流速对产率也有影响,随着N2流速增大,产率先增大后减小,主要原因是
您最近一年使用:0次
名校
解题方法
8 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: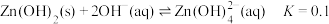 ;
;
②室温下,部分离子浓度的对数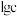 与
与 的关系如下图所示(其中
的关系如下图所示(其中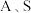 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物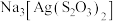 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: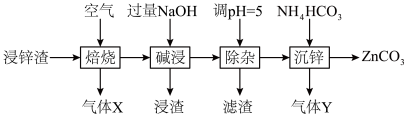
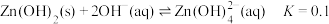 ;
;②室温下,部分离子浓度的对数
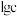 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):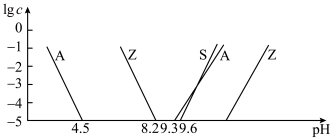
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
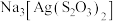 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-04-21更新
|
230次组卷
|
3卷引用:云南省罗平第一中学2024年高三二模考试化学试题
9 . 千金藤素常用于防治肿瘤病患者白细胞减少症、抗疟疾、调节免疫功能等,制备其关键中间体(I)的一种合成路线如下:
(1)化合物A的名称为______ ;化合物C中含有的官能团名称为___________ 。
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途________________ 。
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为_____________________ (写出一种)。
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
(5)下列说法正确的是
(6)参照上述路线,以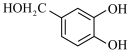 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
①原料ⅲ为_____________ (写结构简式)。
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为_____________________ 。
③最后一步反应类型为____________ 。
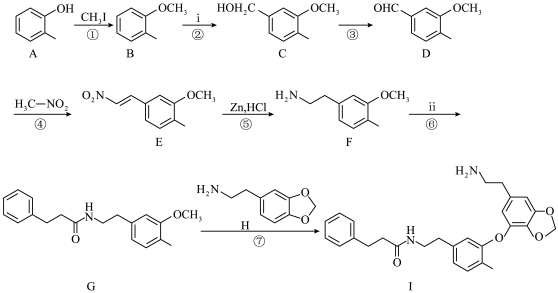
(1)化合物A的名称为
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
序号 | 可反应的试剂 | 反应形成的新结构 | 消耗反应物的物质的量之比 |
① | 新制 | 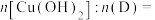 | |
② |
|
|
(5)下列说法正确的是
A.有机物A碳原子杂化方式有 、 、 | B.反应①,有C-I键和H-O键断裂 |
C.1mol化合物B中,含 键16 键16 个 个 | D.产品I属于极性分子,易溶于水和酒精 |
(6)参照上述路线,以
 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:①原料ⅲ为
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为
③最后一步反应类型为
您最近一年使用:0次
10 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在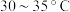 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸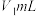 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择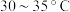 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
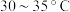 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸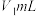 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
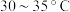 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
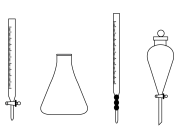
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
2024-06-01更新
|
161次组卷
|
3卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷