1 . 下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)化学性质最不活泼的元素是_____ (填元素名称);
(2)N原子结构示意图为_________ ;Ca的最外层电子数为____ .
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是__________ (填化学式);
(4)C、N和O原子半径由小到大的顺序的是______________ ;
(5)第2周期中气态氢化物最稳定的是_________ ;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是______________ (写出一种).
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是________ 该物质的焰色反应为_____ 色,它暴露在空气中易潮解是因为还含有_________ .
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是_____________________ .
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(1)化学性质最不活泼的元素是
(2)N原子结构示意图为
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是
(4)C、N和O原子半径由小到大的顺序的是
(5)第2周期中气态氢化物最稳定的是
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是
您最近一年使用:0次
2 . 含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放.某含汞酸性废水(主要含Hg2+、H+、Na+、Cl﹣等)的处理工艺流程如图所示.
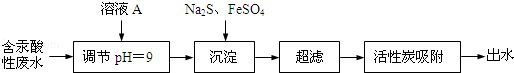
请回答:
(1)含汞废水未经处理直接排放的危害是(填字母)_____ .
a.造成水体污染 b.引起人体中毒
(2)调节废水pH时加入的溶液A可能是(填字母)____ .a.盐酸b.NaOH溶液
(3)Na2S与Hg2+发生反应的离子方程式是_____________________ .
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
则c(Fe2+)=______________ mol/L.

请回答:
(1)含汞废水未经处理直接排放的危害是(填字母)
a.造成水体污染 b.引起人体中毒
(2)调节废水pH时加入的溶液A可能是(填字母)
(3)Na2S与Hg2+发生反应的离子方程式是
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
| 离子 | Na+ | Fe2+ | Cl﹣ | SO42﹣ |
| 浓度(mol/L) | 3.0×10﹣4 | 2.0×10﹣4 | 2.5×10﹣4 |
则c(Fe2+)=
您最近一年使用:0次
3 . 某无色废水中可能含有
H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图象如下所示:Ⅰ:
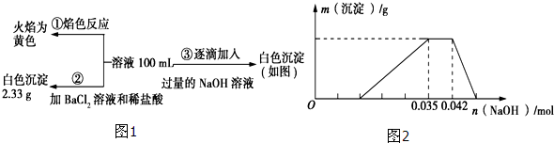
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有_____ ;
(2)实验③中所发生反应的离子反应方程式____ ;
(3)分析图象,在原溶液中c(NH4+)与c(Al3+)的比值为_____ ,NO3-是否存在?_____ 填(“存在”“不存在”或“不确定”)。
Ⅱ:现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复)。
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)A溶液呈碱性的原因是______ (用离子方程式表示);
(2)D是_____ 溶液,E是____ 溶液(均写化学式)。
H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图象如下所示:Ⅰ:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有
(2)实验③中所发生反应的离子反应方程式
(3)分析图象,在原溶液中c(NH4+)与c(Al3+)的比值为
Ⅱ:现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复)。
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)A溶液呈碱性的原因是
(2)D是
您最近一年使用:0次
2016-12-09更新
|
360次组卷
|
2卷引用:2018届高三一轮复习化学:微考点8-与离子反应有关的综合推断
4 . 氮氧化合物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
2NO(g) + O2(g) 2NO2(g) ΔH
2NO2(g) ΔH
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示):
①2NO(g) N2O2(g) ΔH1<0 ②
N2O2(g) ΔH1<0 ②__________________________
(2)在某温度下的一密闭容器中充入一定量的NO2,测得NO2的浓度随时间的变化曲线如下图所示,前5 秒内的O2的平均生成速率为___________________ mol•L-1•s-1,该条件下反应:2NO + O2 2NO2的化学平衡常数数值为
2NO2的化学平衡常数数值为_________________ ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO(g) + O2(g) 2NO2(g) ΔH
2NO2(g) ΔH______ 0(填“<”或 “>”);

(3)2NO(g) + O2(g) 2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)
2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)  2NO2(g)反应速率的是反应
2NO2(g)反应速率的是反应__________ (填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)  2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因
2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________ (反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
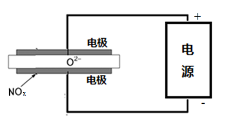
(5)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如右图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为__________________ 。
2NO(g) + O2(g)
 2NO2(g) ΔH
2NO2(g) ΔH(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示):
①2NO(g)
 N2O2(g) ΔH1<0 ②
N2O2(g) ΔH1<0 ②(2)在某温度下的一密闭容器中充入一定量的NO2,测得NO2的浓度随时间的变化曲线如下图所示,前5 秒内的O2的平均生成速率为
 2NO2的化学平衡常数数值为
2NO2的化学平衡常数数值为2NO(g) + O2(g)
 2NO2(g) ΔH
2NO2(g) ΔH
(3)2NO(g) + O2(g)
 2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)
2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)  2NO2(g)反应速率的是反应
2NO2(g)反应速率的是反应 2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因
2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
(5)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如右图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为

您最近一年使用:0次
5 . 金属冶炼和处理常涉及电化学反应。
(1)冶炼或冶炼提纯下列相应金属时没有采用到电解法的是___________
a.Fe b.Na c.Cu d.Al
(2)右图为电解精炼银的示意图,______________ (填a或b)极为含有杂质的粗银;电解过程中,若b极伴有少量无色气体生成,在空气中变红棕色,则生成气体的电极反应式为____________________

(3)银白光亮的银器用久后表面易出现黑斑(Ag2S),为处理黑斑,将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为________________ 。
(4)右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质为CuSO4溶液(足量)。通电一定时间后,A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g ,则A合金中Cu、Zn原子个数比为________________ 。

(1)冶炼或冶炼提纯下列相应金属时没有采用到电解法的是
a.Fe b.Na c.Cu d.Al
(2)右图为电解精炼银的示意图,

(3)银白光亮的银器用久后表面易出现黑斑(Ag2S),为处理黑斑,将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为
(4)右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质为CuSO4溶液(足量)。通电一定时间后,A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g ,则A合金中Cu、Zn原子个数比为

您最近一年使用:0次
6 . 二氧化碳与氢气催化合成甲醇,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)已知:
计算上述反应的△H=_________________ kJ.mol-1。
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是______________________ (填选项字母)。
A.容器内气体密度保持不变
B.CO2的体积分数保持不变
C.H2O(g)与CO2(g)的生成速率之比为1∶1
D.该反应的平衡常数保持不变
E.混合气体的平均相对分子质量不变
F.容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制“图1”:
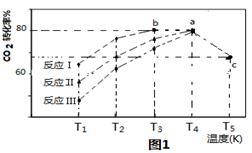
(T5时,图1中C点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_______________ (填“反应I”,“反应II”,“反应III”)。
②T3的b点v(正)_____________ v(逆)(填 “>”, “<”, “="”" )。
③T4的a点转化率比T5的c点高的原因是________________________ 。
④在温度为T5时,该反应的平衡常数K=__________________________ 。
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如“图2”所示。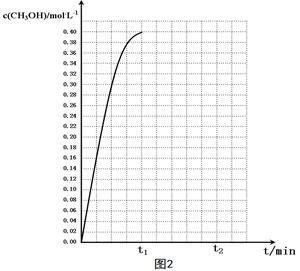
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在 t2时达新平衡。
请在“图2”中画出t1时刻后CH3OH的浓度变化总趋势曲线。
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)(1)已知:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| 键能/kJ·mol-1 | 436 | 326 | 803 | 464 | 414 |
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是
A.容器内气体密度保持不变
B.CO2的体积分数保持不变
C.H2O(g)与CO2(g)的生成速率之比为1∶1
D.该反应的平衡常数保持不变
E.混合气体的平均相对分子质量不变
F.容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制“图1”:
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |

(T5时,图1中C点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是
②T3的b点v(正)
③T4的a点转化率比T5的c点高的原因是
④在温度为T5时,该反应的平衡常数K=
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如“图2”所示。

当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在 t2时达新平衡。
请在“图2”中画出t1时刻后CH3OH的浓度变化总趋势曲线。
您最近一年使用:0次
7 . 钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
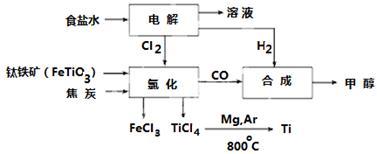
请回答下列问题:
(1)Fe位于元素周期表中第____________ 周期,第___________ 族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式______________ 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于____________ ℃即可。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________ 。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2_____________ mol。

请回答下列问题:
(1)Fe位于元素周期表中第
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)
 CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2
您最近一年使用:0次
8 . 铁及其化合物与生产、生活关系密切,请回答下列问题:
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:__ __。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:_________________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因: 。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:__ 。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示

①写出(a+10)到(a+20)过程中反应的离子方程式:___________________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)= mol
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:__ __。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:_________________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因: 。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:__ 。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示

①写出(a+10)到(a+20)过程中反应的离子方程式:___________________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)= mol
您最近一年使用:0次
9 . 铜是与人类关系非常密切的常见金属。
Ⅰ.已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ = Cu2++ Cu。
(1)CuH中H元素化合价为_________________ 。
(2)目前制备纳米级Cu2O的一种方法:在氢氧化铜悬浊液中滴入N2H4·H2O水溶液,充分反应后即可得到Cu2O,同时产生无色无味的气体。上述制备过程中总反应的化学方程式为________________ 。
(3)一定条件下,在CuSO4中加入NH4H反应生成氢化亚铜(CuH)。将CuH溶解在足量稀硫酸中,当产生6.72 L H2(标准状况下)时,参加反应的硫酸的物质的量为_______________ 。
Ⅱ.孔雀石呈绿色,是一种名贵的宝石。其主要成分是xCu(OH)2·yCuCO3。某兴趣小组为探究孔雀石组成,利用下图所示的装置(夹持仪器省略)进行实验:
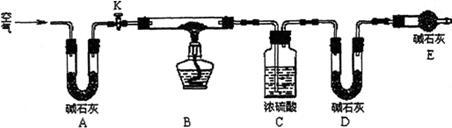
步骤1:检查装置的气密性,将研细的样品置于硬质玻璃管中。
步骤2:称量相关装置的质量,打开活塞K,鼓入空气,一段时间后关闭。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:_________________________。
步骤5:冷却至室温,称量相关装置的质量。
(1)请补充步骤4操作内容:_____________________________ 。
(2)若无装置E,则实验测定的x/y的值将__________ (选填“偏大”、“偏小”或“无影响”)。
(3)某同学在实验过程中采集了如下数据:
为测定x/y的值,你认为可以选用上述所采集数据中的_______________ (写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出孔雀石组成的化学式____________ 。
Ⅰ.已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ = Cu2++ Cu。
(1)CuH中H元素化合价为
(2)目前制备纳米级Cu2O的一种方法:在氢氧化铜悬浊液中滴入N2H4·H2O水溶液,充分反应后即可得到Cu2O,同时产生无色无味的气体。上述制备过程中总反应的化学方程式为
(3)一定条件下,在CuSO4中加入NH4H反应生成氢化亚铜(CuH)。将CuH溶解在足量稀硫酸中,当产生6.72 L H2(标准状况下)时,参加反应的硫酸的物质的量为
Ⅱ.孔雀石呈绿色,是一种名贵的宝石。其主要成分是xCu(OH)2·yCuCO3。某兴趣小组为探究孔雀石组成,利用下图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将研细的样品置于硬质玻璃管中。
步骤2:称量相关装置的质量,打开活塞K,鼓入空气,一段时间后关闭。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:_________________________。
步骤5:冷却至室温,称量相关装置的质量。
(1)请补充步骤4操作内容:
(2)若无装置E,则实验测定的x/y的值将
(3)某同学在实验过程中采集了如下数据:
| A.反应前硬质玻璃管与样品的质量163.8g |
| B.反应后硬质玻璃管中残留固体质量20g |
| C.装置C实验后增重2.25g |
| D.装置D实验后增重5.5g |
为测定x/y的值,你认为可以选用上述所采集数据中的
您最近一年使用:0次
12-13高二下·甘肃兰州·期末
10 . 化合物A(C12H16O3)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8 %,含氢7.0 %,核磁共振氢谱显示只有一个峰。
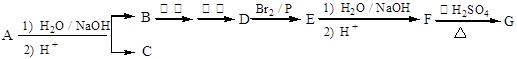
已知:
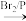
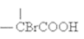
请回答下列问题:
(1)写出G的分子式:_______ 。
(2)写出A的结构简式:_______ 。
(3)写出F→G反应的化学方程式:_______ ,该反应属于_______ (填反应类型)。
(4)写出满足下列条件的C的所有同分异构体:_______ 。
①是苯的对位二取代化合物;
②能与FeCl3溶液发生显色反应;
③不考虑烯醇(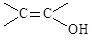 )结构。
)结构。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(仅要求写出1种):_______ 。
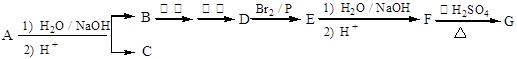
已知:

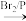
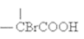
请回答下列问题:
(1)写出G的分子式:
(2)写出A的结构简式:
(3)写出F→G反应的化学方程式:
(4)写出满足下列条件的C的所有同分异构体:
①是苯的对位二取代化合物;
②能与FeCl3溶液发生显色反应;
③不考虑烯醇(
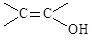 )结构。
)结构。(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(仅要求写出1种):
您最近一年使用:0次
2016-12-08更新
|
807次组卷
|
3卷引用:2016届贵州省遵义市高三上学期第一次联考化学试卷



