1 . 双氧水常被称为化学反应中的“绿色试剂”。已知,在双氧水中加入少量 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:
反应①: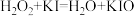 ;
;
反应②: 。
。
回答下列问题:
1.上述反应中属于强电解质的是_____。
2.下列离子在溶液中能大量共存的是_____。
3.标出反应②中的电子转移方向和数目_____ 。

4. 分解过程中,
分解过程中, 的作用是
的作用是_____ 。
5. 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式_____ 。
6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
7.油画变黑,可用一定浓度的 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为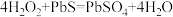 ,下列说法正确的是_____。
,下列说法正确的是_____。
8.向 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。
 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:反应①:
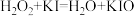 ;
;反应②:
 。
。回答下列问题:
1.上述反应中属于强电解质的是_____。
A. | B. | C.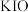 | D. |
A.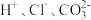 | B.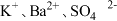 |
C. | D.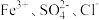 |

4.
 分解过程中,
分解过程中, 的作用是
的作用是5.
 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
7.油画变黑,可用一定浓度的
 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为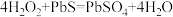 ,下列说法正确的是_____。
,下列说法正确的是_____。A. 是氧化产物 是氧化产物 | B. 被还原 被还原 |
C. 是氧化剂 是氧化剂 | D. 体现还原性 体现还原性 |
 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。A.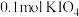 | B.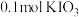 | C.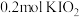 | D.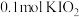 |
您最近一年使用:0次
2 . 乙烯是重要的有机化工基础原料,主要由石油裂解获得,随着石油资源的不断消耗,研究人员已开发出利用天然气替代石油生产乙烯的方法:
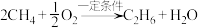
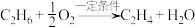
1. 的空间构型为
的空间构型为_______ 。
A.平面正方形 B.三角锥形 C.正四面体
 与
与 属于
属于_______ 。
A.同系物 B.同分异构体 C.同素异形体 D.同位素
2.水果成熟后会释放出乙烯,在水果箱中放入一些用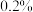 的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。
的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。_______
3.乙烯发生_______ 反应得到聚乙烯。
A.取代 B.聚合 C.氧化
聚乙烯可用于制造_______ 。
A.汽车轮胎 B.塑料大棚薄膜 C.食品保鲜袋 D.棉质内衣
4.乙烯水合制得乙醇。乙醇和_______ 在浓硫酸催化作用下反应生成乙酸乙酯。有研究表明上述反应也可使用甘氨酸 作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势
作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势_______ 。
5.自然界中也存在酯类化合物,如_______ 。
A.蛋白质 B.淀粉 C.油脂 是由_______种氨基酸通过分子间脱水形成的。
是由_______种氨基酸通过分子间脱水形成的。
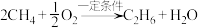
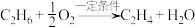
1.
 的空间构型为
的空间构型为A.平面正方形 B.三角锥形 C.正四面体
 与
与 属于
属于A.同系物 B.同分异构体 C.同素异形体 D.同位素
2.水果成熟后会释放出乙烯,在水果箱中放入一些用
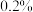 的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。
的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。3.乙烯发生
A.取代 B.聚合 C.氧化
聚乙烯可用于制造
A.汽车轮胎 B.塑料大棚薄膜 C.食品保鲜袋 D.棉质内衣
4.乙烯水合制得乙醇。乙醇和
 作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势
作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势5.自然界中也存在酯类化合物,如
A.蛋白质 B.淀粉 C.油脂
很多药物中含有酯的结构,如医药史上三大经典药物之一的解热镇痛药阿司匹林,其主要成分是乙酰水杨酸(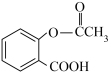 )。写出乙酰水杨酸分子中含有的官能团
)。写出乙酰水杨酸分子中含有的官能团
 是由_______种氨基酸通过分子间脱水形成的。
是由_______种氨基酸通过分子间脱水形成的。| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
名校
解题方法
3 . 聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)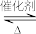 CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____ (保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____ ;A、B、C、D四点中,v正最大的是___ ,v逆最大的是____ 。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____ 时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___ (填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____ 。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
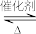 CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
您最近一年使用:0次
2020-02-11更新
|
890次组卷
|
7卷引用:山东省2020年普通高中学业水平等级考试模拟试题
山东省2020年普通高中学业水平等级考试模拟试题【省级联考】山东省2020届新高考模拟统考化学试题河南省洛阳市2020届高三上学期期末模拟考试化学试题(已下线)第24讲 化学平衡常数及转化率的计算(精练)-2021年高考化学一轮复习讲练测(已下线)小题29 化学平衡的相关计算——备战2021年高考化学经典小题考前必刷(全国通用)湖北省沙市中学2021-2022学年高二上学期期末考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题
4 . 分(1)根据如图所示情况,判断下列说法中正确的是________________ 。

(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,该反应的热化学方程式是________________________ 。
(3)已知反应: N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4的反应焓变为__________ (用含△H1、△H2、△H3的式子表示)。

| A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH |
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,该反应的热化学方程式是
(3)已知反应: N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4的反应焓变为
您最近一年使用:0次
2019-01-30更新
|
107次组卷
|
2卷引用:2015-2016学年福建省四地六校高二上学期10月联考化学试卷
10-11高二上·湖南·阶段练习
名校
5 . 在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________ 。
(2)该反应为______ 反应(选填吸热、放热)。
升高温度CO2的转化将____________ (填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是______ (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______ ℃。
CO2(g)+H2(g)
 CO(g)+H2O(g),
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
升高温度CO2的转化将
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
您最近一年使用:0次
2019-01-30更新
|
1103次组卷
|
41卷引用:2011-2012学年北京市第六十六中学高二上学期补考化学试卷
(已下线)2011-2012学年北京市第六十六中学高二上学期补考化学试卷2015-2016学年陕西省城固一中高二下学业水平模拟测试化学试卷(已下线)2010年海南省嘉积中学高二上学期第二次月考化学试卷(已下线)2010—2011学年浙江省海盐元济高级中学高二3月月考化学试卷(已下线)2010-2011学年广东省中山市桂山中学高二下期中考试化学试卷(已下线)2011-2012学年山东省兖州市高二上学期期中考试化学试卷(已下线)2011-2012学年安徽省六安市徐集中学高二上学期期末考试化学试卷(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2011-2012学年广东始兴县风度中学高二下学期期中考试理综化学试卷(已下线)2011学年浙江省瑞安十校高二第二学期期中联考化学试卷(已下线)2011-2012学年广东省始兴县风度中学高二下学期期末考试理综化学卷(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2013届贵州晴隆民族中学高三上学期期中考试理科综合化学试卷(已下线)2013届辽宁省实验中学分校高三12月月考化学试卷(已下线)2012-2013学年广东东莞第七高级中学高二上期中考试化学试卷(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(已下线)2012-2013学年新疆兵团农二师华山中学高二上学期期末考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷(已下线)2013-2014学年贵州省册亨县民族中学高二上学期期末考试化学试卷(已下线)2014年高二化学人教版选修四 9化学平衡常数练习卷(已下线)2015安徽望江中学同步课时练(人教选修4)2.3.3化学平衡常数试卷2014-2015学年黑龙江省伊春市伊春二中高二上学期期中化学试卷2014-2015学年吉林省松原市扶余县第一中学高一下期末化学试卷2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(理)化学试卷2016届甘肃省武威二中高三下学期开学考试理综化学试卷2015-2016学年吉林省延边三中高二上12月月考化学试卷2016-2017学年河北省秦皇岛北戴河中学高二上月考化学试卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷吉林省汪清县第六中学2018届高三9月月考化学试题甘肃省武威市第六中学2017-2018学年高二上学期第一次学段考试化学试题河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第三次月考化学试题江西省临川实验学校2017-2018学年高二上学期期末质量检测化学试题内蒙古阿拉善左旗高级中学2017-2018学年高二上学期期末考试化学试题西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题甘肃省宁县二中2018-2019学年高二上学期期中考试化学试题山西省忻州二中2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区石河子二中2018-2019学年高二上学期第二次月考化学试题甘肃省靖远四中2018-2019学年高二第二学期开学检测化学试题海南省临高县临高中学2019-2020学年高二上学期期中考试化学试题
6 . 环保材料的研发和使用为绿色生活提供了可能。由—种生物可降解的高分子材料甲制备的一次性餐盒,对保护环境有较大的帮助,甲的单体[CH3CH(OH)COOH]可通过以下方法合成:
 ① 流程中①的反应类型为
① 流程中①的反应类型为________ 。化合物D中官能团的名称为羟基和________ 。
② B分子中化学环境不同的氢原子有________ 种。
③ 化合物A发生加聚反应生成的有机产物的结构简式为________ 。
④ 两分子的D发生反应,可生成链状和环状两种化合物,其中环状化合物的结构简式为________ 。
 ① 流程中①的反应类型为
① 流程中①的反应类型为② B分子中化学环境不同的氢原子有
③ 化合物A发生加聚反应生成的有机产物的结构简式为
④ 两分子的D发生反应,可生成链状和环状两种化合物,其中环状化合物的结构简式为
您最近一年使用:0次
7 . 1 000 mL某待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
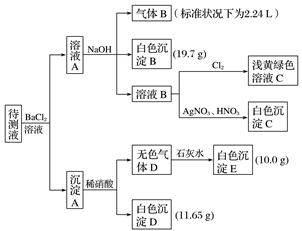
(1)写出生成白色沉淀B的离子方程式:__________________________________ 。
(2)待测液中肯定不存在的阳离子是________________ 。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在____ (填“是”或“否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:________________________ 。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是________________ 。
②沉淀A中能与稀硝酸反应的成分是____________ (写化学式)。
| 阳离子 | K+、NH 、Fe3+、Ba2+ 、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO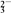 、HCO 、HCO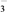 、SO 、SO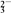 、SO 、SO |
现进行如下实验操作(每次实验所加试剂均过量):

(1)写出生成白色沉淀B的离子方程式:
(2)待测液中肯定不存在的阳离子是
(3)若无色气体D是单一气体:判断原溶液中K+是否存在
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是
②沉淀A中能与稀硝酸反应的成分是
您最近一年使用:0次
8 . 已知氧化性:BrO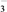 >ClO
>ClO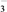 >Cl2>IO
>Cl2>IO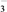 >I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
>I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
(1)可观察到的现象是
①_________________________________________________ ;
②_________________________________________________ 。
(2)写出有关反应的离子方程式:
①___________________________________________ ;
②___________________________________________ 。
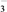 >ClO
>ClO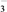 >Cl2>IO
>Cl2>IO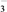 >I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
>I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。(1)可观察到的现象是
①
②
(2)写出有关反应的离子方程式:
①
②
您最近一年使用:0次
2017-09-23更新
|
177次组卷
|
2卷引用:2018届高三一轮复习化学:考点12-氧化性、还原性强弱的比较
名校
9 . Ⅰ.工业上可用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:

(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________ (用K1、K2表示)。500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________ (填“>”、“=”或“<”)v逆。
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是______________ 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________ 。

Ⅱ.利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g) CH3OH(g)。一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如下图所示。
CH3OH(g)。一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如下图所示。

(1)p1________ (填“>”、“<”或“=”)p2,理由是_____________________________ 。
(2)该甲醇合成反应在A点的平衡常数K=______________ (用a和V表示)。
(3)该反应达到平衡时,反应物转化率的关系是CO________ (填“>”、“<”或“=”)H2。
(4)下列措施中能够同时满足增大反应速率和提高CO转化率的是________ (填字母)。
A.使用高效催化剂
B.降低反应温度
C.增大体系压强
D.不断将CH3OH从反应混合物中分离出来

(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是

Ⅱ.利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)
 CH3OH(g)。一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如下图所示。
CH3OH(g)。一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如下图所示。
(1)p1
(2)该甲醇合成反应在A点的平衡常数K=
(3)该反应达到平衡时,反应物转化率的关系是CO
(4)下列措施中能够同时满足增大反应速率和提高CO转化率的是
A.使用高效催化剂
B.降低反应温度
C.增大体系压强
D.不断将CH3OH从反应混合物中分离出来
您最近一年使用:0次
2017-09-21更新
|
632次组卷
|
6卷引用:2018届高三一轮复习化学:微考点57-全面破解平衡常数
10 .
(1)室温时纯水中c(H+)=c(OH-),向纯水中加入少量下列固体物质:
A.NaOH B.Na2SO4C.NH4Cl
试回答如下问题:
I.溶液中H+、OH-浓度变化情况(填“变大”“减小”或“不变”)
II. c(H+)与c(OH-)大小比较(填“>”“<”或“=”)
III.溶液的酸碱性(填“酸性”“碱性”或“中性”)
请按上述要求补完整表中相关内容
(2)已知25℃合成氨反应中,1 mol N2完全转化为NH3时释放的能量为92.4 kJ。X现将1 molN2和3 mol H2混合置于2 L密闭容器中,反应进行到2 s末测得NH3为0.4mol。试回答:
①该反应的热化学方方程式为________________________ 。
②该反应达到平衡后,升高温度平衡向_____ (填“正”或“逆”)反应方向移动;增大压强平衡向_____ (填“正”或“逆”)反应方向移动;加入催化剂平衡________ (填“能”或“不能”)移动。
③前2 s内v(H2)为_____________ 。
(1)室温时纯水中c(H+)=c(OH-),向纯水中加入少量下列固体物质:
A.NaOH B.Na2SO4C.NH4Cl
试回答如下问题:
I.溶液中H+、OH-浓度变化情况(填“变大”“减小”或“不变”)
II. c(H+)与c(OH-)大小比较(填“>”“<”或“=”)
III.溶液的酸碱性(填“酸性”“碱性”或“中性”)
请按上述要求补完整表中相关内容
| A.NaOH | a Na2SO4 | C.NH4C1 | |
| c(H+) | 减少 | ① | 增大 |
| c(OH-) | ② | 不变 | ③ |
| c(H+)与c(OH-)的大小比较 | ④ | = | > |
| 溶液的酸碱性 | 碱性 | ⑤ | 酸性 |
(2)已知25℃合成氨反应中,1 mol N2完全转化为NH3时释放的能量为92.4 kJ。X现将1 molN2和3 mol H2混合置于2 L密闭容器中,反应进行到2 s末测得NH3为0.4mol。试回答:
①该反应的热化学方方程式为
②该反应达到平衡后,升高温度平衡向
③前2 s内v(H2)为
您最近一年使用:0次



