名校
解题方法
1 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)存贮时,Na应保存在______ 中。
(2)工业上采用电解熔融NaCl(熔点为 )制备金属Na,电解反应方程式:
)制备金属Na,电解反应方程式: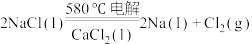 ,加入
,加入 的目的是
的目的是______ (填序号)。
a.作催化剂,加块电解反应的速率
b.作还原剂,将 还原为
还原为
c.作助熔剂,降低生产过程的能耗
d.作氧化剂,将 氧化为
氧化为
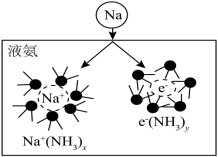
(3)钠能与液氨反应,生成氨基钠(NaNH2)和一种气体单质。将钠投入液氨中,会快速得到深蓝色溶液(生成蓝色的溶剂合电子,如图所示),后慢慢产生气泡。______ (填分子式)
②当 钠投入液氨生成0.05mol气体时,Na共失去的电子
钠投入液氨生成0.05mol气体时,Na共失去的电子______ 0.05mol(填“>”、“<”或“=”)
(4)采用空气和Na为原料可直接制备Na2O2.为防止空气中的某些成分与Na2O2反应,空气与熔融金属Na反应前需依次通过______ 。(填序号)
a.无水 b.饱和食盐水c.饱和
b.饱和食盐水c.饱和 溶液d.
溶液d. 溶液e.
溶液e. 溶液
溶液
(5)对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体
充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体 的质量为
的质量为______ g。
(6)为确定 和
和 混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸
混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸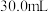 ,充分反应,产生
,充分反应,产生 的体积(已折算成标准状况下的体积,不考虑
的体积(已折算成标准状况下的体积,不考虑 在水中的溶解)如下表:
在水中的溶解)如下表:
①样品中物质的量之比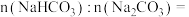
______ 。
②稀盐酸的物质的量浓度
______ mol/L。
(1)存贮时,Na应保存在
(2)工业上采用电解熔融NaCl(熔点为
 )制备金属Na,电解反应方程式:
)制备金属Na,电解反应方程式: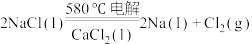 ,加入
,加入 的目的是
的目的是a.作催化剂,加块电解反应的速率
b.作还原剂,将
 还原为
还原为
c.作助熔剂,降低生产过程的能耗
d.作氧化剂,将
 氧化为
氧化为
(3)钠能与液氨反应,生成氨基钠(NaNH2)和一种气体单质。将钠投入液氨中,会快速得到深蓝色溶液(生成蓝色的溶剂合电子,如图所示),后慢慢产生气泡。
②当
 钠投入液氨生成0.05mol气体时,Na共失去的电子
钠投入液氨生成0.05mol气体时,Na共失去的电子(4)采用空气和Na为原料可直接制备Na2O2.为防止空气中的某些成分与Na2O2反应,空气与熔融金属Na反应前需依次通过
a.无水
 b.饱和食盐水c.饱和
b.饱和食盐水c.饱和 溶液d.
溶液d. 溶液e.
溶液e. 溶液
溶液(5)对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体
充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体 的质量为
的质量为(6)为确定
 和
和 混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸
混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸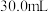 ,充分反应,产生
,充分反应,产生 的体积(已折算成标准状况下的体积,不考虑
的体积(已折算成标准状况下的体积,不考虑 在水中的溶解)如下表:
在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
 体积(mL) 体积(mL) | 672 | 840 | 896 | 672 |
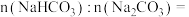
②稀盐酸的物质的量浓度

您最近一年使用:0次
解题方法
2 . 脱除和利用 具有重要意义。
具有重要意义。
(1)研究表明,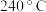 时在催化剂作用下,
时在催化剂作用下, 还原
还原 生成S经历:
生成S经历: 的过程,且每步中都有
的过程,且每步中都有 生成。
生成。
①第一步转化的化学方程式为_______ 。
②第二步转化中生成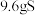 时转移的电子数为
时转移的电子数为_______ 。
(2)软锰矿浆(含 及少量
及少量 等)吸收烟气中
等)吸收烟气中 的方法如图所示。
的方法如图所示。
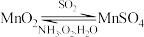
①写出在 溶液中转化为
溶液中转化为 的化学方程式:
的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。15小时后pH迅速下降,其主要原因是
吸收率的变化关系如图所示。15小时后pH迅速下降,其主要原因是_______ 。 碱性溶液吸收
碱性溶液吸收 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作催化剂,催化过程的示意图如图所示。若过程2生成的O与
作催化剂,催化过程的示意图如图所示。若过程2生成的O与 个数比为
个数比为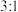 ,写出过程2的离子方程式:
,写出过程2的离子方程式:_______ 。 的方法:将
的方法:将 转化为
转化为 ,再将
,再将 与等物质的量的甲醇反应转化为化合物A。
与等物质的量的甲醇反应转化为化合物A。_______ 。
②一定压强下,化合物A的沸点低于硫酸的原因是_______ 。
 具有重要意义。
具有重要意义。(1)研究表明,
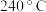 时在催化剂作用下,
时在催化剂作用下, 还原
还原 生成S经历:
生成S经历: 的过程,且每步中都有
的过程,且每步中都有 生成。
生成。①第一步转化的化学方程式为
②第二步转化中生成
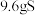 时转移的电子数为
时转移的电子数为(2)软锰矿浆(含
 及少量
及少量 等)吸收烟气中
等)吸收烟气中 的方法如图所示。
的方法如图所示。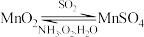
①写出在
 溶液中转化为
溶液中转化为 的化学方程式:
的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。15小时后pH迅速下降,其主要原因是
吸收率的变化关系如图所示。15小时后pH迅速下降,其主要原因是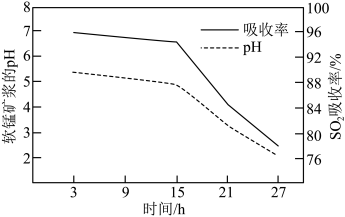
 碱性溶液吸收
碱性溶液吸收 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作催化剂,催化过程的示意图如图所示。若过程2生成的O与
作催化剂,催化过程的示意图如图所示。若过程2生成的O与 个数比为
个数比为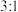 ,写出过程2的离子方程式:
,写出过程2的离子方程式: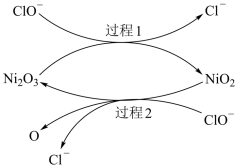
 的方法:将
的方法:将 转化为
转化为 ,再将
,再将 与等物质的量的甲醇反应转化为化合物A。
与等物质的量的甲醇反应转化为化合物A。已知: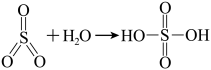
②一定压强下,化合物A的沸点低于硫酸的原因是
您最近一年使用:0次
7日内更新
|
44次组卷
|
2卷引用:江苏省南通市崇川区2025届高三上学期第一次调研考试化学试题
名校
3 . 羰基化合物中,羰基邻位碳原子上的氢原子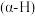 受到羰基吸电子作用的影响具有一定的活泼性,因此醛或酮在碱性条件下会发生羟醛缩合反应,如图:
受到羰基吸电子作用的影响具有一定的活泼性,因此醛或酮在碱性条件下会发生羟醛缩合反应,如图:___________ ,B中碳___________ 和碳___________ (填编号)之间的碳碳键是新构建的。
(2) 的反应类型是
的反应类型是___________ ,B的结构简式是___________ 。
(3)2,2-二甲基丙醛与丙酮在碱性条件下发生羟醛缩合反应的方程式为___________ (省略中间体)。
(4)丙醛与丁醛混合后,加入 溶液发生羟醛缩合反应,生成碳原子数小于9的产物(不含中间体,不考虑立体异构,存在共轭现象)有
溶液发生羟醛缩合反应,生成碳原子数小于9的产物(不含中间体,不考虑立体异构,存在共轭现象)有___________ 种,其中核磁共振氢谱为5组峰的产物的结构简式是___________ 。
(5)依据逆合成分析法,利用羟醛缩合反应合成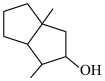 ,试设计其中间体及原料完成图合成路线中间体1
,试设计其中间体及原料完成图合成路线中间体1________ ,中间体2_________ ,原料________ 。
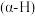 受到羰基吸电子作用的影响具有一定的活泼性,因此醛或酮在碱性条件下会发生羟醛缩合反应,如图:
受到羰基吸电子作用的影响具有一定的活泼性,因此醛或酮在碱性条件下会发生羟醛缩合反应,如图: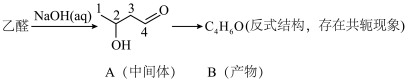
(2)
 的反应类型是
的反应类型是(3)2,2-二甲基丙醛与丙酮在碱性条件下发生羟醛缩合反应的方程式为
(4)丙醛与丁醛混合后,加入
 溶液发生羟醛缩合反应,生成碳原子数小于9的产物(不含中间体,不考虑立体异构,存在共轭现象)有
溶液发生羟醛缩合反应,生成碳原子数小于9的产物(不含中间体,不考虑立体异构,存在共轭现象)有(5)依据逆合成分析法,利用羟醛缩合反应合成
 ,试设计其中间体及原料完成图合成路线中间体1
,试设计其中间体及原料完成图合成路线中间体1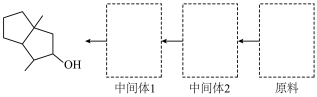
您最近一年使用:0次
4 . 氟单质及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子价电子的电子排布式为___________ 。
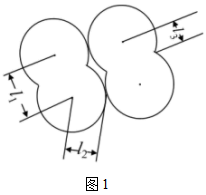
(2)范德华半径是指分子晶体中共价分子之间的最短距离。图1中可看成氟单质的范德华半径的是___________ (填 、
、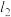 或
或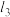 )。
)。___________ (填元素符号)。
(4)液态HF存在自耦电离: ,试解释形成
,试解释形成 的原因
的原因___________ , 的VSEPR模型的名称为
的VSEPR模型的名称为___________ 。
(5)1962年,青年化学家N。Bartlett用Xe和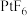 合成了氙的第一个化合物—
合成了氙的第一个化合物—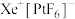 ,震惊了化学界,
,震惊了化学界, 、
、 、
、 也随之合成。下列说法不正确的是___________
也随之合成。下列说法不正确的是___________
(6)由Xe和F构成的化合物的晶体属四方晶系,晶胞参数如图2所示,晶胞棱边夹角均为90°。已知Xe和F原子的共价半径分别为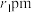 和
和 ,空间利用率是指构成晶体的原子在整个晶体空间中所占有的体积百分比。
,空间利用率是指构成晶体的原子在整个晶体空间中所占有的体积百分比。___________ 。(用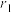 、
、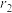 、a、c表示)
、a、c表示)
(1)基态F原子价电子的电子排布式为
(2)范德华半径是指分子晶体中共价分子之间的最短距离。图1中可看成氟单质的范德华半径的是
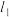 、
、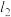 或
或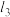 )。
)。
(4)液态HF存在自耦电离:
 ,试解释形成
,试解释形成 的原因
的原因 的VSEPR模型的名称为
的VSEPR模型的名称为(5)1962年,青年化学家N。Bartlett用Xe和
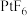 合成了氙的第一个化合物—
合成了氙的第一个化合物—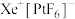 ,震惊了化学界,
,震惊了化学界, 、
、 、
、 也随之合成。下列说法不正确的是___________
也随之合成。下列说法不正确的是___________A.该化合物中基态阳离子的价电子排布式为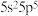 |
| B.合成过程中Xe为还原剂 |
C.可推测Ne也会和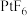 化合 化合 |
D.Xe属于p区元素, 中心原子杂化方式是 中心原子杂化方式是 |
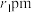 和
和 ,空间利用率是指构成晶体的原子在整个晶体空间中所占有的体积百分比。
,空间利用率是指构成晶体的原子在整个晶体空间中所占有的体积百分比。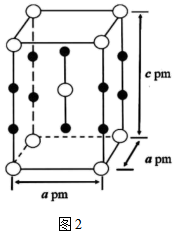
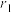 、
、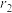 、a、c表示)
、a、c表示)
您最近一年使用:0次
名校
解题方法
5 . 重铬酸钠(Na2Cr2O7)是一种重要的氧化剂,以铬铁矿(FeO·Cr2O3,含 Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程如下:
(1)焙烧时FeO·Cr2O3 转化成Fe2O3 和 Na2CrO4 的化学方程式___________ 。
(2)“浸取”过程中,可以加快反应速率的方法是___________ (写出一种即可)
(3)矿物中相关元素可溶性组分物质的量浓度 c 与pH 的关系如图 a 所示。当溶液中可溶组分浓度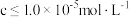 时,可认为已除尽。则调节 pH 步骤, pH 的理论范围为
时,可认为已除尽。则调节 pH 步骤, pH 的理论范围为___________ ;滤渣 2 的成份是:___________ 。
(4)加H2SO4 酸化的目的是:___________ (用离子方程式解释),H2SO4 也可选用“焙烧”步骤产生的 ___________ (填化学式)代替。
(5)已知 Na2Cr2O7 和 Na2SO4 的溶解度随温度变化的关系如图 b,则蒸发得到“副产品”的操作包括___________ 、洗涤、干燥等步骤。


(1)焙烧时FeO·Cr2O3 转化成Fe2O3 和 Na2CrO4 的化学方程式
(2)“浸取”过程中,可以加快反应速率的方法是
(3)矿物中相关元素可溶性组分物质的量浓度 c 与pH 的关系如图 a 所示。当溶液中可溶组分浓度
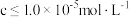 时,可认为已除尽。则调节 pH 步骤, pH 的理论范围为
时,可认为已除尽。则调节 pH 步骤, pH 的理论范围为(4)加H2SO4 酸化的目的是:
(5)已知 Na2Cr2O7 和 Na2SO4 的溶解度随温度变化的关系如图 b,则蒸发得到“副产品”的操作包括
您最近一年使用:0次
2024-09-13更新
|
85次组卷
|
2卷引用:四川省内江市威远中学校2024-2025学年高三上学期9月月考化学试题
名校
6 . 碘及其化合物在生产生活中有重要作用。
(1)一定温度下在 的密闭容器内发生反应:
的密闭容器内发生反应: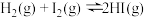 ,开始时通入
,开始时通入 和一定量的
和一定量的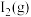 ,各物质的浓度随时间的变化情况如图所示,其中
,各物质的浓度随时间的变化情况如图所示,其中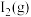 的浓度变化曲线前半部分已略去。
的浓度变化曲线前半部分已略去。___________ (填“>”“<”或“=”)B点。
②从反应开始至刚达到平衡, 的平均反应速率为
的平均反应速率为___________ 。
③起始时 的物质的量为
的物质的量为___________  。
。
④下列能说明反应已达平衡状态的是___________ (填序号)。
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的 键数目与断裂的
键数目与断裂的 键数目相等
键数目相等
c.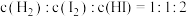
d.
e.反应混合体系的颜色不再发生变化
(2)某小组同学在室温下进行“碘钟实验”:将浓度均为 的
的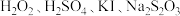 溶液及淀粉混合,一定时间后溶液变为蓝色。
溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为 反应分两步进行:
反应分两步进行:
第1步:___________; 第2步:
①第1步的离子方程式是___________ ,对于总反应, 的作用是
的作用是___________ 。
②为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、Ⅱ(溶液浓度均为 )。
)。
溶液从混合时的无色变为蓝色的时间:实验Ⅰ是 、实验Ⅱ是
、实验Ⅱ是 。实验Ⅱ中,
。实验Ⅱ中,
___________ ;对比实验Ⅰ、Ⅱ,可得出的实验结论是___________ 。
(1)一定温度下在
 的密闭容器内发生反应:
的密闭容器内发生反应: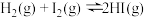 ,开始时通入
,开始时通入 和一定量的
和一定量的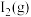 ,各物质的浓度随时间的变化情况如图所示,其中
,各物质的浓度随时间的变化情况如图所示,其中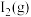 的浓度变化曲线前半部分已略去。
的浓度变化曲线前半部分已略去。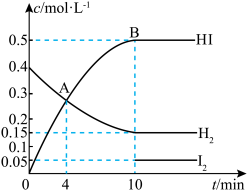
②从反应开始至刚达到平衡,
 的平均反应速率为
的平均反应速率为③起始时
 的物质的量为
的物质的量为 。
。④下列能说明反应已达平衡状态的是
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的
 键数目与断裂的
键数目与断裂的 键数目相等
键数目相等c.
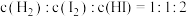
d.

e.反应混合体系的颜色不再发生变化
(2)某小组同学在室温下进行“碘钟实验”:将浓度均为
 的
的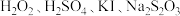 溶液及淀粉混合,一定时间后溶液变为蓝色。
溶液及淀粉混合,一定时间后溶液变为蓝色。已知:“碘钟实验”的总反应的离子方程式为
 反应分两步进行:
反应分两步进行:第1步:___________; 第2步:

①第1步的离子方程式是
 的作用是
的作用是②为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、Ⅱ(溶液浓度均为
 )。
)。| 序号 | 试剂和用量 | ||||
 溶液 溶液 |  溶液 溶液 |  溶液 溶液 |  溶液(含淀粉) 溶液(含淀粉) |  | |
| 实验I | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅱ | 5 | 2 | x | y | z |
 、实验Ⅱ是
、实验Ⅱ是 。实验Ⅱ中,
。实验Ⅱ中,
您最近一年使用:0次
名校
解题方法
7 . L亚砷酸( )可以用作防腐剂、杀虫剂和除草剂,
)可以用作防腐剂、杀虫剂和除草剂, 是三元弱酸,在溶液中存在多种含砷微粒。25℃时各种微粒物质的量分数与溶液pH的关系如图所示。其中a点横坐标值为9.3.回答下列问题。
是三元弱酸,在溶液中存在多种含砷微粒。25℃时各种微粒物质的量分数与溶液pH的关系如图所示。其中a点横坐标值为9.3.回答下列问题。___________ 。
(2)将NaOH溶液滴加到 溶液中,当pH从12调至13时,发生的主要反应的离子方程式是
溶液中,当pH从12调至13时,发生的主要反应的离子方程式是
___________ °
(3) 可写成
可写成 ,
, 的前两步电离是通过和水中
的前两步电离是通过和水中 结合实现的,如第一步电离可以表示为:
结合实现的,如第一步电离可以表示为: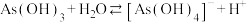 ,第二步电离方程式为:
,第二步电离方程式为:___________ 。
(4)将 和
和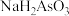 固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足
固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足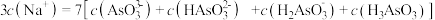 关系时,向水中加入的
关系时,向水中加入的 和
和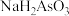 固体的物质的量之比为
固体的物质的量之比为___________ 。
(5)25℃,亚砷酸( )的第一步电离平衡常数
)的第一步电离平衡常数
___________ ,当 时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为
时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为___________ 。
 )可以用作防腐剂、杀虫剂和除草剂,
)可以用作防腐剂、杀虫剂和除草剂, 是三元弱酸,在溶液中存在多种含砷微粒。25℃时各种微粒物质的量分数与溶液pH的关系如图所示。其中a点横坐标值为9.3.回答下列问题。
是三元弱酸,在溶液中存在多种含砷微粒。25℃时各种微粒物质的量分数与溶液pH的关系如图所示。其中a点横坐标值为9.3.回答下列问题。
(2)将NaOH溶液滴加到
 溶液中,当pH从12调至13时,发生的主要反应的离子方程式是
溶液中,当pH从12调至13时,发生的主要反应的离子方程式是(3)
 可写成
可写成 ,
, 的前两步电离是通过和水中
的前两步电离是通过和水中 结合实现的,如第一步电离可以表示为:
结合实现的,如第一步电离可以表示为: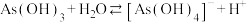 ,第二步电离方程式为:
,第二步电离方程式为:(4)将
 和
和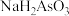 固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足
固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足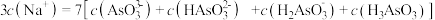 关系时,向水中加入的
关系时,向水中加入的 和
和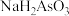 固体的物质的量之比为
固体的物质的量之比为(5)25℃,亚砷酸(
 )的第一步电离平衡常数
)的第一步电离平衡常数
 时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为
时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为
您最近一年使用:0次
解题方法
8 . 研究电解质在水溶液中的平衡能了解它的存在形式。 的溶液中逐滴加入
的溶液中逐滴加入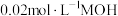 溶液,所得溶液的
溶液,所得溶液的 随
随 溶液的体积变化如图甲所示(溶液体积变化忽略不计)。
溶液的体积变化如图甲所示(溶液体积变化忽略不计)。
①常温下,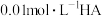 溶液中由水电离出的
溶液中由水电离出的
_____  。
。
②常温下一定浓度的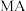 稀溶液的
稀溶液的 ,则
,则
_____ 7(填“>”、“<”或“=”),用离子方程式表示其原因为_____ ;
③ 点时,溶液中
点时,溶液中 、
、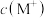 、
、 由大到小的顺序是
由大到小的顺序是_____ ;
④ 点时,溶液中
点时,溶液中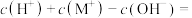
_____  。
。
(2) 时,在
时,在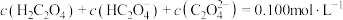 的
的 、
、 混合溶液中,
混合溶液中, 、
、 、
、 的物质的量分数
的物质的量分数 随溶液
随溶液 变化的关系如图乙所示。
变化的关系如图乙所示。
① 点:
点:
_____ 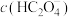 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
②该温度下 的电离常数
的电离常数
_____ 。
(3)常温下,现有 均为11的标签模糊的
均为11的标签模糊的 和
和 溶液。
溶液。
① 溶液中由水电离出来的
溶液中由水电离出来的 浓度与
浓度与 溶液中水电离出来
溶液中水电离出来 浓度之比为
浓度之比为_____ ;
②甲同学设计如下实验予以区别:各取 两种溶液加水稀释至
两种溶液加水稀释至 ,分别测定其
,分别测定其 。请问甲同学是如何判断哪瓶溶液为
。请问甲同学是如何判断哪瓶溶液为 溶液?
溶液?_____ 。
③乙同学各取 两种溶液,分别滴加少量
两种溶液,分别滴加少量 溶液观察有无沉淀或气体进行鉴别。则其中溶液滴加后同时产生沉淀和气体的反应的离子方程式为:
溶液观察有无沉淀或气体进行鉴别。则其中溶液滴加后同时产生沉淀和气体的反应的离子方程式为:_____ 。

 的溶液中逐滴加入
的溶液中逐滴加入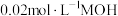 溶液,所得溶液的
溶液,所得溶液的 随
随 溶液的体积变化如图甲所示(溶液体积变化忽略不计)。
溶液的体积变化如图甲所示(溶液体积变化忽略不计)。①常温下,
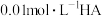 溶液中由水电离出的
溶液中由水电离出的
 。
。②常温下一定浓度的
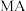 稀溶液的
稀溶液的 ,则
,则
③
 点时,溶液中
点时,溶液中 、
、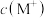 、
、 由大到小的顺序是
由大到小的顺序是④
 点时,溶液中
点时,溶液中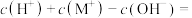
 。
。(2)
 时,在
时,在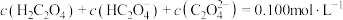 的
的 、
、 混合溶液中,
混合溶液中, 、
、 、
、 的物质的量分数
的物质的量分数 随溶液
随溶液 变化的关系如图乙所示。
变化的关系如图乙所示。①
 点:
点:
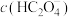 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)②该温度下
 的电离常数
的电离常数
(3)常温下,现有
 均为11的标签模糊的
均为11的标签模糊的 和
和 溶液。
溶液。①
 溶液中由水电离出来的
溶液中由水电离出来的 浓度与
浓度与 溶液中水电离出来
溶液中水电离出来 浓度之比为
浓度之比为②甲同学设计如下实验予以区别:各取
 两种溶液加水稀释至
两种溶液加水稀释至 ,分别测定其
,分别测定其 。请问甲同学是如何判断哪瓶溶液为
。请问甲同学是如何判断哪瓶溶液为 溶液?
溶液?③乙同学各取
 两种溶液,分别滴加少量
两种溶液,分别滴加少量 溶液观察有无沉淀或气体进行鉴别。则其中溶液滴加后同时产生沉淀和气体的反应的离子方程式为:
溶液观察有无沉淀或气体进行鉴别。则其中溶液滴加后同时产生沉淀和气体的反应的离子方程式为:
您最近一年使用:0次
解题方法
9 . 回答下列问题:
(1)某同学配制 溶液,回答问题:
溶液,回答问题:
①用托盘天平称取 固体
固体___________ g。
②配制过程所需的玻璃仪器有烧杯、量筒、___________ 。
③定容时仰视刻度线,则所配制的溶液的浓度会___________ (填“偏高”“偏低”或“不变”)。
(2)现有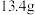 由
由 和
和 组成的混合气体,在标准状况下体积为
组成的混合气体,在标准状况下体积为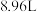 。回答问题:
。回答问题:
①混合气体中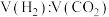 为
为___________ 。
②混合气体中各组分原子个数比 为
为___________ 。
(3)正常人的血液中葡萄糖(简称血糖,分子式为 ,相对分子质量为180)的浓度在
,相对分子质量为180)的浓度在 之间,今测得某病人
之间,今测得某病人 血液中含葡萄糖
血液中含葡萄糖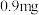 ,相当于
,相当于___________ 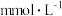 。
。
(4)科学家利用原子示踪法探究催化剂机理时发现,催化剂不是没有参加反应,只是反应前后催化剂的质量与性质不变。已知氯酸钾在二氧化锰催化下分解反应的第一步反应方程式为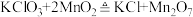 ,请写出第二步反应的化学方程式:
,请写出第二步反应的化学方程式:______________ 。
(1)某同学配制
 溶液,回答问题:
溶液,回答问题:①用托盘天平称取
 固体
固体②配制过程所需的玻璃仪器有烧杯、量筒、
③定容时仰视刻度线,则所配制的溶液的浓度会
(2)现有
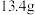 由
由 和
和 组成的混合气体,在标准状况下体积为
组成的混合气体,在标准状况下体积为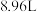 。回答问题:
。回答问题:①混合气体中
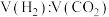 为
为②混合气体中各组分原子个数比
 为
为(3)正常人的血液中葡萄糖(简称血糖,分子式为
 ,相对分子质量为180)的浓度在
,相对分子质量为180)的浓度在 之间,今测得某病人
之间,今测得某病人 血液中含葡萄糖
血液中含葡萄糖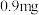 ,相当于
,相当于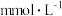 。
。(4)科学家利用原子示踪法探究催化剂机理时发现,催化剂不是没有参加反应,只是反应前后催化剂的质量与性质不变。已知氯酸钾在二氧化锰催化下分解反应的第一步反应方程式为
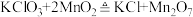 ,请写出第二步反应的化学方程式:
,请写出第二步反应的化学方程式:
您最近一年使用:0次
解题方法
10 . 硫酸亚硝酰合铁{化学式: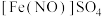 }是著名的棕色环实验产物。某实验小组制备
}是著名的棕色环实验产物。某实验小组制备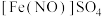 并分析其性质。
并分析其性质。
已知:反应原理为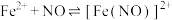 。
。
(1)制备 (夹持装置略)。
(夹持装置略)。_______ 。
②将气体转化装置B补充完整并标明所用试剂_______ 。
③装置D的作用为吸收未反应完的NO尾气,D中离子方程式为_______ 。(已知:氮被氧化为 ;D中还溶有
;D中还溶有 )
)
④将C中溶液结晶得到 晶体的过程中必须隔绝空气,否则会产生红褐色难溶物。利用平衡移动原理解释产生红褐色难溶物的原因是
晶体的过程中必须隔绝空气,否则会产生红褐色难溶物。利用平衡移动原理解释产生红褐色难溶物的原因是_______ 。
(2)查阅资料可知,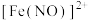 中铁的化合价为
中铁的化合价为 。
。
①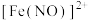 中铁的价电子都在
中铁的价电子都在 能级,并且满足洪特规则。可以推测该离子中,铁有
能级,并且满足洪特规则。可以推测该离子中,铁有_______ 个未成对电子。
②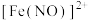 中配体
中配体 中N和O都通过化学键而达到稳定结构,
中N和O都通过化学键而达到稳定结构, 应包含
应包含_______ 个 键和
键和_______ 个 键。
键。
(3)分别取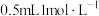 的
的 溶液与
溶液与 的
的 溶液,将两者混合,小心加入
溶液,将两者混合,小心加入 浓硫酸。发现液体分为两层,稍后,在两层液体交界处出现棕色环。经检验,棕色物质是
浓硫酸。发现液体分为两层,稍后,在两层液体交界处出现棕色环。经检验,棕色物质是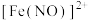 。写出生成
。写出生成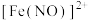 的总反应离子方程式:
的总反应离子方程式:_______ 。
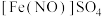 }是著名的棕色环实验产物。某实验小组制备
}是著名的棕色环实验产物。某实验小组制备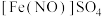 并分析其性质。
并分析其性质。已知:反应原理为
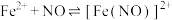 。
。(1)制备
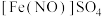 (夹持装置略)。
(夹持装置略)。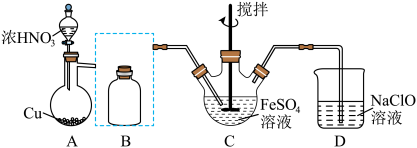
②将气体转化装置B补充完整并标明所用试剂
③装置D的作用为吸收未反应完的NO尾气,D中离子方程式为
 ;D中还溶有
;D中还溶有 )
)④将C中溶液结晶得到
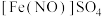 晶体的过程中必须隔绝空气,否则会产生红褐色难溶物。利用平衡移动原理解释产生红褐色难溶物的原因是
晶体的过程中必须隔绝空气,否则会产生红褐色难溶物。利用平衡移动原理解释产生红褐色难溶物的原因是(2)查阅资料可知,
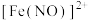 中铁的化合价为
中铁的化合价为 。
。①
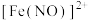 中铁的价电子都在
中铁的价电子都在 能级,并且满足洪特规则。可以推测该离子中,铁有
能级,并且满足洪特规则。可以推测该离子中,铁有②
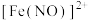 中配体
中配体 中N和O都通过化学键而达到稳定结构,
中N和O都通过化学键而达到稳定结构, 应包含
应包含 键和
键和 键。
键。(3)分别取
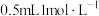 的
的 溶液与
溶液与 的
的 溶液,将两者混合,小心加入
溶液,将两者混合,小心加入 浓硫酸。发现液体分为两层,稍后,在两层液体交界处出现棕色环。经检验,棕色物质是
浓硫酸。发现液体分为两层,稍后,在两层液体交界处出现棕色环。经检验,棕色物质是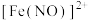 。写出生成
。写出生成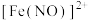 的总反应离子方程式:
的总反应离子方程式:
您最近一年使用:0次
2024-08-23更新
|
35次组卷
|
2卷引用:辽宁省部分学校2023-2024学年高三上学期12月月考化学试题



