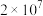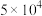名校
解题方法
1 . 铁被誉为“工业之母”,铁也是人体必须的痕量元素之一。
(1)基态Fe原子的核外电子中有_______ 对成对电子。其重要化合物 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为_______ ,其中Fe的配位数为_______ 。
(2)血红素(含 )是吡咯(
)是吡咯(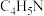 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:_______ ,请描述原因:_______ 。
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为_______ 个(设 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______ 。
③CO中毒是由于CO与血红蛋白(Hb)发生配位反应: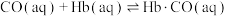 K。
K。
已知CO、 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。
则反应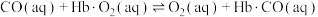 的平衡常数
的平衡常数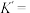
_______ 。
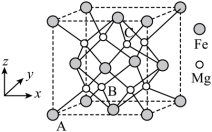
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。 ,B点原子的分数坐标为
,B点原子的分数坐标为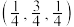 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ 。
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的 ,则该晶体的化学式为
,则该晶体的化学式为_______ ,晶胞密度为_______  (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
(1)基态Fe原子的核外电子中有
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为(2)血红素(含
 )是吡咯(
)是吡咯(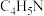 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图: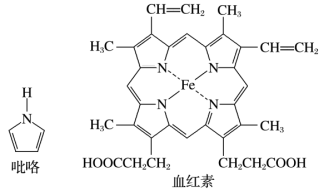
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为
 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为③CO中毒是由于CO与血红蛋白(Hb)发生配位反应:
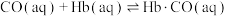 K。
K。已知CO、
 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。CO |
| |
配位常数K |
|
|
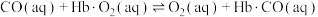 的平衡常数
的平衡常数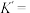
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。
 ,B点原子的分数坐标为
,B点原子的分数坐标为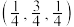 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的
 ,则该晶体的化学式为
,则该晶体的化学式为 (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
2 . I. 和
和 在工农业、科研等方面应用广泛。
在工农业、科研等方面应用广泛。
(1) (氨硼烷)是具有广泛应用前景的储氢材料。
(氨硼烷)是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是___________ 。
② 的沸点高于
的沸点高于 的可能原因是
的可能原因是___________ 。
(2)工业合成 时用到含铁催化剂。
时用到含铁催化剂。
① 元素在周期表第
元素在周期表第___________ 族,基态 原子电子的空间运动状态有
原子电子的空间运动状态有___________ 种。
②从结构的角度分析 容易被氧化成
容易被氧化成 的原因是
的原因是___________ 。
(3) 合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时,
合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时, 分子在晶胞的体心和棱的中心位置。
分子在晶胞的体心和棱的中心位置。 合金中,每个
合金中,每个 原子周围与它最近且相等距离的
原子周围与它最近且相等距离的 原子有
原子有___________ 个。
②要储存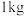
 ,至少需要
,至少需要___________ 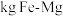 合金。
合金。
II.请回答:
(4)下列说法中正确的有___________ 。
①金属晶体的导电性、导热性均与自由电子有关
②若晶体中有阳离子,必然有阴离子
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧ 和
和 晶体中,阴离子周围紧邻的阳离子数均为8
晶体中,阴离子周围紧邻的阳离子数均为8
 和
和 在工农业、科研等方面应用广泛。
在工农业、科研等方面应用广泛。(1)
 (氨硼烷)是具有广泛应用前景的储氢材料。
(氨硼烷)是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②
 的沸点高于
的沸点高于 的可能原因是
的可能原因是(2)工业合成
 时用到含铁催化剂。
时用到含铁催化剂。①
 元素在周期表第
元素在周期表第 原子电子的空间运动状态有
原子电子的空间运动状态有②从结构的角度分析
 容易被氧化成
容易被氧化成 的原因是
的原因是(3)
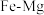 合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时,
合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时, 分子在晶胞的体心和棱的中心位置。
分子在晶胞的体心和棱的中心位置。
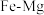 合金中,每个
合金中,每个 原子周围与它最近且相等距离的
原子周围与它最近且相等距离的 原子有
原子有②要储存
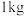
 ,至少需要
,至少需要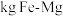 合金。
合金。II.请回答:
(4)下列说法中正确的有
①金属晶体的导电性、导热性均与自由电子有关
②若晶体中有阳离子,必然有阴离子
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧
 和
和 晶体中,阴离子周围紧邻的阳离子数均为8
晶体中,阴离子周围紧邻的阳离子数均为8
您最近一年使用:0次
名校
解题方法
3 . 以软锰矿(主要含有MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备KMnO4的工艺流程如图所示:
①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于_______ 区,核外电子占据最高能层的符号是_______ ,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用_______ “理论”解释。
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为_______ 。
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为_______ 。
(4)“除Ca、Mg”时,所得滤液中 =
=_______ 。
(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为_______ 。
②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为_______ 。
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为_______ (填“阴极”或“阳极”)。
②阳极的电极反应式为_______ 。

①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为
(4)“除Ca、Mg”时,所得滤液中
 =
=(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO
 )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为
②阳极的电极反应式为
您最近一年使用:0次
名校
解题方法
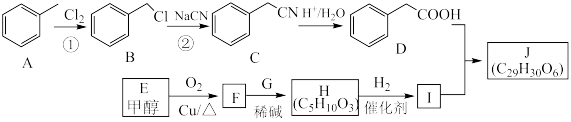
4 . 化合物J是一种治疗高脂血症的药物,其合成路线如图:______ ,反应H→I的反应类型为______ 。
(2)化合物J中的官能团为______ 。
(3)E→F反应的化学方程式为____________ 。
(4)H的结构简式为______ 。
(5)K是D的同系物,其相对分子质量比D多14,满足下列条件的K的同分异构体共有______ 种(不考虑立体异构)。
①苯环上只有两个侧链
②能与Na反应生成
③能与银氨溶液发生银镜反应
K的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同的是______ (填字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
Ⅱ. 。
。
(2)化合物J中的官能团为
(3)E→F反应的化学方程式为
(4)H的结构简式为
(5)K是D的同系物,其相对分子质量比D多14,满足下列条件的K的同分异构体共有
①苯环上只有两个侧链
②能与Na反应生成

③能与银氨溶液发生银镜反应
K的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同的是
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
您最近一年使用:0次
名校
5 . 二氯化二硫( )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)有关 的下列说法正确的是 。
的下列说法正确的是 。
(2)选用以下装置制取少量 (加热及夹持装置略):
(加热及夹持装置略):_____________________ 。
②装置连接顺序:A→__________ →D。
③B中玻璃纤维的作用是______________________ 。
④D中的最佳试剂是__________ (选填序号)。
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。_________ (填标号);
a. 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
 )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)有关
 的下列说法正确的是 。
的下列说法正确的是 。A. 中S-Cl键的键能大于S-S键的键能 中S-Cl键的键能大于S-S键的键能 | B.固态时 属于原子晶体 属于原子晶体 |
| C.第一电离能、电负性均为:Cl>S | D. 中既有极性键又有非极性键 中既有极性键又有非极性键 |
(2)选用以下装置制取少量
 (加热及夹持装置略):
(加热及夹持装置略):
②装置连接顺序:A→
③B中玻璃纤维的作用是
④D中的最佳试剂是
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
a.
 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
您最近一年使用:0次
名校
6 . 利用 合成甲醇、二甲醚技术是有效利用
合成甲醇、二甲醚技术是有效利用 资源,实现“碳中和”目标的重要途径。
资源,实现“碳中和”目标的重要途径。
(1)开发 直接催化加氢合成二甲醚技术是很好的一个研究方向。
直接催化加氢合成二甲醚技术是很好的一个研究方向。
主反应: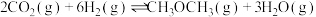

副反应:

①已知25℃和101kPa下,H2(g)、CO(g)的燃烧热 分别为-285.8kJ/mol、-283.0kJ/mol,
分别为-285.8kJ/mol、-283.0kJ/mol,
 ,则
,则
_______ kJ/mol。
②其他条件相同时,反应温度对 平衡转化率影响如图所示。温度低于280℃时,
平衡转化率影响如图所示。温度低于280℃时, 平衡转化率随温度的升高而减小的原因可能是
平衡转化率随温度的升高而减小的原因可能是_______ 。 ,反应平衡时测得
,反应平衡时测得 的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性
的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性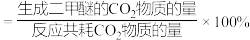 ),则副反应
),则副反应 的
的
_______ (保留两位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)利用 合成甲醇也是有效利用
合成甲醇也是有效利用 资源的重要途径。将原料气
资源的重要途径。将原料气 充入某一恒容密闭容器中,只发生
充入某一恒容密闭容器中,只发生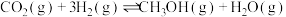
 ,在不同催化剂作用下,反应
,在不同催化剂作用下,反应 时
时 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。_______ 。
A.使用催化剂Ⅰ时,d点已达到平衡
B. 的平衡常数大于
的平衡常数大于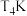 的平衡常数
的平衡常数
C.若a点时, ,则此条件下反应已达到最大限度
,则此条件下反应已达到最大限度
D.c点转化率比a点低的原因一定是催化剂活性降低
②若图中a点时反应已达平衡,现原料气按 充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出
充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出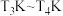 之间
之间 的平衡转化率变化曲线
的平衡转化率变化曲线______ 。
(3)水煤气变换反应的机理被广泛研究,其中有一种为羧基机理,某催化剂催化 (*表示吸附态、
(*表示吸附态、 表示活化能)步骤如下:
表示活化能)步骤如下:
Ⅰ.

Ⅱ._______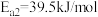
Ⅲ.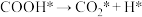

Ⅳ._______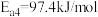
①请补充其中的一个反应式:Ⅱ_______ 。
②反应 的决速步骤是
的决速步骤是_______ (填序号)。
 合成甲醇、二甲醚技术是有效利用
合成甲醇、二甲醚技术是有效利用 资源,实现“碳中和”目标的重要途径。
资源,实现“碳中和”目标的重要途径。(1)开发
 直接催化加氢合成二甲醚技术是很好的一个研究方向。
直接催化加氢合成二甲醚技术是很好的一个研究方向。主反应:
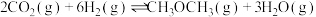

副反应:


①已知25℃和101kPa下,H2(g)、CO(g)的燃烧热
 分别为-285.8kJ/mol、-283.0kJ/mol,
分别为-285.8kJ/mol、-283.0kJ/mol,
 ,则
,则
②其他条件相同时,反应温度对
 平衡转化率影响如图所示。温度低于280℃时,
平衡转化率影响如图所示。温度低于280℃时, 平衡转化率随温度的升高而减小的原因可能是
平衡转化率随温度的升高而减小的原因可能是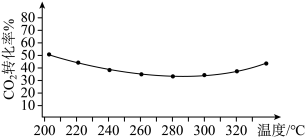
 ,反应平衡时测得
,反应平衡时测得 的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性
的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性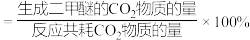 ),则副反应
),则副反应 的
的
(2)利用
 合成甲醇也是有效利用
合成甲醇也是有效利用 资源的重要途径。将原料气
资源的重要途径。将原料气 充入某一恒容密闭容器中,只发生
充入某一恒容密闭容器中,只发生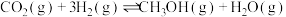
 ,在不同催化剂作用下,反应
,在不同催化剂作用下,反应 时
时 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。
A.使用催化剂Ⅰ时,d点已达到平衡
B.
 的平衡常数大于
的平衡常数大于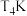 的平衡常数
的平衡常数C.若a点时,
 ,则此条件下反应已达到最大限度
,则此条件下反应已达到最大限度D.c点转化率比a点低的原因一定是催化剂活性降低
②若图中a点时反应已达平衡,现原料气按
 充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出
充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出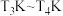 之间
之间 的平衡转化率变化曲线
的平衡转化率变化曲线(3)水煤气变换反应的机理被广泛研究,其中有一种为羧基机理,某催化剂催化
 (*表示吸附态、
(*表示吸附态、 表示活化能)步骤如下:
表示活化能)步骤如下:Ⅰ.


Ⅱ._______
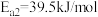
Ⅲ.
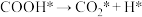

Ⅳ._______
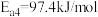
①请补充其中的一个反应式:Ⅱ
②反应
 的决速步骤是
的决速步骤是
您最近一年使用:0次
名校
7 . Ⅰ.用如图所示的装置测定中和反应的反应热。____ ,其能否用铜质材料替代?____ (填“能”或“不能”)。
(2)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:
 的
的
_______ (保留一位小数)。
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为_______ mL。
根据表中数据计算可得该NaOH溶液的物质的量浓度为_______ (保留四位有效数字) 。
。
(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。
(6)写出滴定的离子方程式:_______ 。
(7)用酸性 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在_______ (填“酸式”或“碱式”)滴定管中,滴定终点的现象是_______ 。

(2)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为1
的碱溶液各50mL混合(溶液密度均为1 ),生成溶液的比热容
),生成溶液的比热容 ,测得温度如表所示:
,测得温度如表所示:| 反应物 | 起始温度 /℃ /℃ | 最高温度 /℃ /℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
 的
的
Ⅱ.某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 硫酸的体积/mL 硫酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 。
。(5)下列操作可能使所测NaOH溶液的浓度数值偏小的是_______(填选项字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始时仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
Ⅲ.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的
 溶液的浓度,现用0.1000
溶液的浓度,现用0.1000 的酸性
的酸性 溶液进行滴定。
溶液进行滴定。(6)写出滴定的离子方程式:
(7)用酸性
 溶液进行滴定时,酸性
溶液进行滴定时,酸性 溶液应该装在
溶液应该装在
您最近一年使用:0次
名校
8 . KCN易溶于水,水溶液呈碱性,虽有剧毒,却因其较强的配位能力被广泛使用,如用于从低品位的金矿砂(含单质金)中提取金。
(1)基态N价层电子排布式为_______ 。
(2) 的所有原子均满足8电子稳定结构,其电子式为
的所有原子均满足8电子稳定结构,其电子式为_______ 。
(3) 中N为-3价,从结构与性质关系的角度解释其原因:
中N为-3价,从结构与性质关系的角度解释其原因:_______ 。
(4)下图为KCN的晶胞示意图。已知晶胞边长为anm,阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  。(已知:
。(已知: )
)
ⅰ.将金矿砂溶于pH为10.5~11的KCN溶液,过滤,得含 的滤液;
的滤液;
ⅱ.向滤液中加入足量金属锌,得单质金。
已知Au与Cu同族,则Au属于_______ 区元素。
②ⅰ中反应的离子方程式为_______ 。
铝和硅均处于第三周期金属与非金属的交界处。
(6)比较Al和Si的原子半径:Al_______ Si。
(7)硅的一种化合物 可发生水解反应,机理如下:
可发生水解反应,机理如下: 、②
、② 、③
、③ ,中间体
,中间体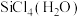 中Si采取的杂化类型为
中Si采取的杂化类型为_______ (填标号)。
(8)氯化铝常以二聚体的形式存在( )具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
)具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头_______ 。
(1)基态N价层电子排布式为
(2)
 的所有原子均满足8电子稳定结构,其电子式为
的所有原子均满足8电子稳定结构,其电子式为(3)
 中N为-3价,从结构与性质关系的角度解释其原因:
中N为-3价,从结构与性质关系的角度解释其原因:(4)下图为KCN的晶胞示意图。已知晶胞边长为anm,阿伏加德罗常数的值为
 ,该晶体的密度为
,该晶体的密度为 。(已知:
。(已知: )
)
ⅰ.将金矿砂溶于pH为10.5~11的KCN溶液,过滤,得含
 的滤液;
的滤液;ⅱ.向滤液中加入足量金属锌,得单质金。
已知Au与Cu同族,则Au属于
②ⅰ中反应的离子方程式为
铝和硅均处于第三周期金属与非金属的交界处。
(6)比较Al和Si的原子半径:Al
(7)硅的一种化合物
 可发生水解反应,机理如下:
可发生水解反应,机理如下:
 、②
、② 、③
、③ ,中间体
,中间体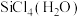 中Si采取的杂化类型为
中Si采取的杂化类型为(8)氯化铝常以二聚体的形式存在(
 )具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
)具有配位键,分子中原子间成键的关系如下图所示。请将图中表示配位键的斜线上加上箭头
您最近一年使用:0次
名校
9 . 金银花中抗菌杀毒的有效成分为绿原酸,绿原酸的一种合成路线如图所示。
(1)A中含有的官能团名称为_______ ;B的化学名称为_______ 。
(2)D→E的化学方程式为_______ ,E→F的反应类型为_______ 。
(3) J与足量Na反应,生成
J与足量Na反应,生成 的体积(标准状况下)为
的体积(标准状况下)为_______ L。
(4)设计K→L的目的是_______ 。
(5)绿原酸在碱性条件下完全水解后,再酸化得到芳香族化合物M,N是M的同分异构体,写出其中一种符合下列条件的N的结构简式:_______ 。
A.能与 溶液发生显色反应
溶液发生显色反应
B.分子中只含有两种官能团
C.该分子的核磁共振氢谱图中有4组峰,且峰面积之比为3:2:2:1
(6)参考上述合成路线及所学知识,请设计一条以 和
和 为原料合成
为原料合成 的路线
的路线_______ (无机试剂任选)。

已知: 。
。
(1)A中含有的官能团名称为
(2)D→E的化学方程式为
(3)
 J与足量Na反应,生成
J与足量Na反应,生成 的体积(标准状况下)为
的体积(标准状况下)为(4)设计K→L的目的是
(5)绿原酸在碱性条件下完全水解后,再酸化得到芳香族化合物M,N是M的同分异构体,写出其中一种符合下列条件的N的结构简式:
A.能与
 溶液发生显色反应
溶液发生显色反应B.分子中只含有两种官能团
C.该分子的核磁共振氢谱图中有4组峰,且峰面积之比为3:2:2:1
(6)参考上述合成路线及所学知识,请设计一条以
 和
和 为原料合成
为原料合成 的路线
的路线
您最近一年使用:0次
7日内更新
|
56次组卷
|
2卷引用:河北省邢台市邢襄联盟2023-2024学年高二下学期5月第三次月考化学试题
名校
解题方法
10 . 乙酸苯酯是重要的药物中间体,它可以转化得到邻羟基苯乙酮和对羟基苯乙酮的混合物。一种制备乙酸苯酯的原理为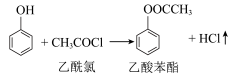 ,利用如图装置制备并提纯乙酸苯酯。
,利用如图装置制备并提纯乙酸苯酯。

已知所用试剂的部分物理性质如表所示:
| 物质 | 相对分子质量 | 部分物理性质 |
| 苯酚 | 94 | 常温下,纯净的苯酚是无色晶体,沸点为181.7℃,溶于水、乙醇,易溶于乙醚等有机溶剂 |
| 乙酰氯 | 78.5 | 常温下为无色发烟液体,沸点为52℃,溶于丙酮、乙醚等有机溶剂 |
| 乙酸苯酯 | 136 | 常温下为无色液体,沸点为195.5℃,微溶于水,可混溶于醇、氯仿、醚等有机溶剂 |
| 环己烷 | 84 | 常温下为无色有刺激性气味的液体,沸点为80.7℃,不溶于水,溶于乙醚、乙醇等有机溶剂 |
(1)仪器甲的名称为
(2)该原理制备乙酸苯酯的反应类型为
(3)其他条件相同,控制反应温度,不同温度下得到的乙酸苯酯的产率如表所示,选择表中
温度/℃ | 10 | 15 | 20 | 25 | 30 |
产率/% | 68.51 | 83.34 | 95.55 | 92.68 | 91.82 |
(4)实验结束后,进一步提纯乙酸苯酯的方法为
(5)在最佳温度下反应,最终得到乙酸苯酯的质量为
您最近一年使用:0次
7日内更新
|
27次组卷
|
2卷引用:河北省邢台市邢襄联盟2023-2024学年高二下学期5月第三次月考化学试题