1 . 工业上可以用 和
和 反应生成燃料甲醇,制备甲醇的化学方程式如下:
反应生成燃料甲醇,制备甲醇的化学方程式如下:
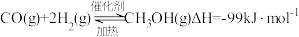
回答下列问题:
1.找到合适的催化剂是实现反应工业化的关键。该反应使用催化剂可以实现的目标有_____。
2.某温度下,将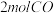 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后,达到平衡时测得
后,达到平衡时测得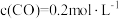 ,则
,则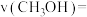
_____ 。
3.将 和
和 按照等物质的量进行反应,测得
按照等物质的量进行反应,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
4.反应中的 ,可由如下反应制得:
,可由如下反应制得: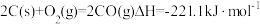 ,判断该反应能否自发进行,并简述原因:
,判断该反应能否自发进行,并简述原因:_____ 。
5.甲醇燃料电池以甲醇为燃料,其工作原理示意图:_____ 极。
(2)写出a极反应式_____ 。
6. ,两种酸的电离平衡常数如表所示:
,两种酸的电离平衡常数如表所示:
(1)写出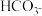 的电离平衡常数表达式
的电离平衡常数表达式
_____ 。
(2)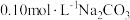 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为_____ 。
(3)向 溶液中加入足量的
溶液中加入足量的 溶液,发生反应的离子方程式是
溶液,发生反应的离子方程式是_____ 。
7.碳酸钙沉淀能溶于盐酸,用平衡移动原理解释其原因:_____ 。
 和
和 反应生成燃料甲醇,制备甲醇的化学方程式如下:
反应生成燃料甲醇,制备甲醇的化学方程式如下: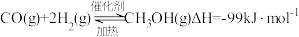
回答下列问题:
1.找到合适的催化剂是实现反应工业化的关键。该反应使用催化剂可以实现的目标有_____。
| A.缩短达到平衡所需时间 | B.增大甲醇的体积分数 |
| C.提高单位时间内甲醇的产量 | D.提高 的平衡转化率 的平衡转化率 |
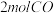 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后,达到平衡时测得
后,达到平衡时测得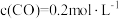 ,则
,则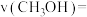
3.将
 和
和 按照等物质的量进行反应,测得
按照等物质的量进行反应,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
A.温度: | B.正反应速率: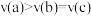 |
C.平衡常数: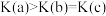 | D.平均摩尔质量: |
 ,可由如下反应制得:
,可由如下反应制得: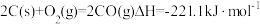 ,判断该反应能否自发进行,并简述原因:
,判断该反应能否自发进行,并简述原因:5.甲醇燃料电池以甲醇为燃料,其工作原理示意图:
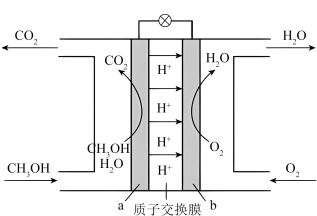
(2)写出a极反应式
6.
 ,两种酸的电离平衡常数如表所示:
,两种酸的电离平衡常数如表所示: |  | |
 | 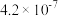 | 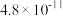 |
 |  |  |
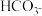 的电离平衡常数表达式
的电离平衡常数表达式
(2)
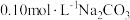 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为(3)向
 溶液中加入足量的
溶液中加入足量的 溶液,发生反应的离子方程式是
溶液,发生反应的离子方程式是7.碳酸钙沉淀能溶于盐酸,用平衡移动原理解释其原因:
您最近一年使用:0次
2 . 过二硫酸钠( )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: 。
。
(1)写出装置中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。
(2)盛装NaOH溶液的仪器名称为___________ ,持续通入氮气的目的是___________ 。
(3)装置中硫酸的作用是___________ 。
(4)某兴趣小组设计实验探究不同环境下 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
①在___________ (填“中性”“酸性”或“碱性”)条件下, 的氧化能力最强。
的氧化能力最强。
②若用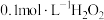 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___________ ;达到滴定终点时,消耗 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中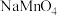 的质量为
的质量为___________ g(用含 的代数式表示,
的代数式表示,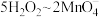 )
)
 )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: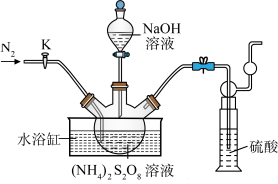
 。
。(1)写出装置中生成
 的反应的化学方程式:
的反应的化学方程式:(2)盛装NaOH溶液的仪器名称为
(3)装置中硫酸的作用是
(4)某兴趣小组设计实验探究不同环境下
 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变为深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色( ) ) | 10s后溶液逐渐变为深紫色( ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀硫酸无明显现象 | 煮沸3min后,有气泡冒出 |
 的氧化能力最强。
的氧化能力最强。②若用
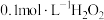 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中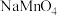 的质量为
的质量为 的代数式表示,
的代数式表示,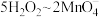 )
)
您最近一年使用:0次
名校
解题方法
3 . 硫酸铜可用于游泳池消毒,工业上一种利用含铜矿石(主要含 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示:
(1)为了提高“焙烧”的反应速率,可采取的措施为__________ (任写一种即可)。
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、 ),
), 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
(3)“酸溶”后,溶液中的金属阳离子有__________ ;“滤渣a”用途为__________ (任写一点即可)。
(4)“转化”时发生反应的离子方程式为__________ ,不能将双氧水替换为硝酸的原因是__________ ,“一系列操作”包括蒸发浓缩、__________ 、过滤、干燥。
(5)硫酸铜晶体(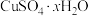 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为 ,则结晶水
,则结晶水
__________ (用字母表示)。
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为 ,晶胞参数为
,晶胞参数为 。
。
①O的配位数为__________ 。
②阿伏加德罗常数=__________ (用含 、a的字母表示)。
、a的字母表示)。
 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示: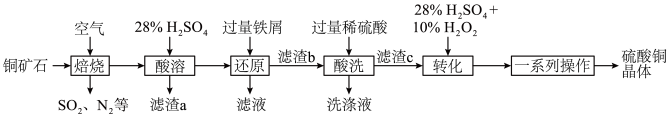
(1)为了提高“焙烧”的反应速率,可采取的措施为
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、
 ),
), 发生反应的化学方程式为
发生反应的化学方程式为(3)“酸溶”后,溶液中的金属阳离子有
(4)“转化”时发生反应的离子方程式为
(5)硫酸铜晶体(
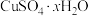 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为 ,则结晶水
,则结晶水
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为
 ,晶胞参数为
,晶胞参数为 。
。①O的配位数为
②阿伏加德罗常数=
 、a的字母表示)。
、a的字母表示)。
您最近一年使用:0次
2024-04-10更新
|
195次组卷
|
3卷引用:河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)
名校
4 . 化合物H(磷酸奥司他韦)适用于流感病毒的治疗,尤其对甲流效果明显,部分合成路线如下:
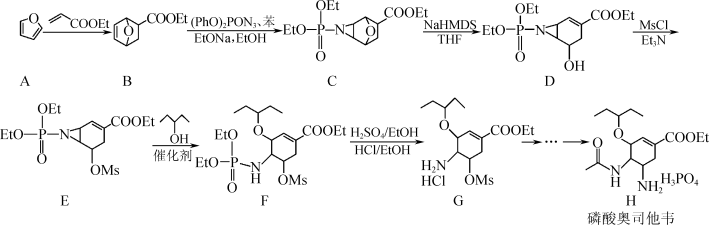
注:Et-:C2H5-;Ms-: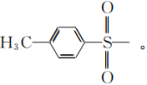
(1)H中含氧官能团的名称为醚键、___________ ;A→B的反应类型为___________ 。
(2)D→E反应中使用Et3N的作用为___________ 。
(3)E转化为F时有副产品M(与F互为同分异构体)生成,M的结构简式为___________ 。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________ 。
①分子中含有3种不同化学环境的氢原子;
②不能与FeCl3发生显色反应;
③1mol该同分异构体能与活泼金属钠反应产生1.5molH2。
(5)写出以 、CH3CH2OH、(PhO)2PON3为原料制备
、CH3CH2OH、(PhO)2PON3为原料制备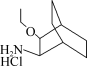 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。__________

注:Et-:C2H5-;Ms-:

(1)H中含氧官能团的名称为醚键、
(2)D→E反应中使用Et3N的作用为
(3)E转化为F时有副产品M(与F互为同分异构体)生成,M的结构简式为
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①分子中含有3种不同化学环境的氢原子;
②不能与FeCl3发生显色反应;
③1mol该同分异构体能与活泼金属钠反应产生1.5molH2。
(5)写出以
 、CH3CH2OH、(PhO)2PON3为原料制备
、CH3CH2OH、(PhO)2PON3为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
您最近一年使用:0次
解题方法
5 . NBICS化学学习小组为探究由三种元素构成的化合物X的组成和性质,设计并完成如下实验(假设各步反应均完全,反应中气体完全逸出,气体体积为标准状况),已知B为气体,E的焰色为黄色,C为两种正盐的混合物。
(1)固体X的化学式是___________
(2)写出X受热分解的化学方程式:___________ 。
(3)写出混合物C与稀硫酸反应产生F的离子方程式:___________ 。
(4)请设计实验方案,检验气体B常见的化学性质(三种):___________ 。
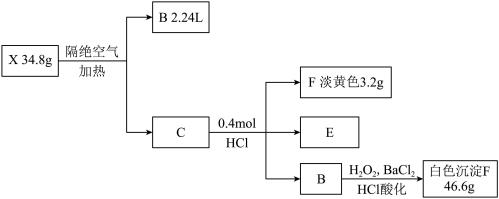
(1)固体X的化学式是
(2)写出X受热分解的化学方程式:
(3)写出混合物C与稀硫酸反应产生F的离子方程式:
(4)请设计实验方案,检验气体B常见的化学性质(三种):
您最近一年使用:0次
解题方法
6 . 表列出了①~⑨九种元素在周期表中的位置:
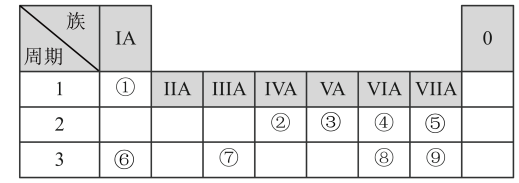
(1)①~⑨九种元素中原子半径最大的是_____ (填元素符号)。
(2)元素③的原子结构示意图为_____ ;元素①与⑨组成的化合物的电子式:_____ ;由⑤、⑥两种元素组成的化合物的化学键类型为_____ (“离子键”或“共价键”)。
(3)元素③、④的简单氢化物的稳定性较弱的是_____ (填化学式);元素⑧、⑨的最高价氧化物对应的水化物中,酸性较强的是_____ (填化学式)。
(4)元素①与②所形成的最简单有机物的空间结构是_____ ,该物质与⑨的单质在光照下发生反应,该反应的产物是_____ (填“纯净物”或“混合物”)。元素①与②所形成的最简单烯烃为M,写出M与元素⑨的单质在一定条件下反应的化学方程式:_____ ,该反应类型为_____ 。
(5)元素⑧的单质在空气中燃烧生成_____ 色固体,此固体与二氧化碳反应的化学方程式为_____ 。

(1)①~⑨九种元素中原子半径最大的是
(2)元素③的原子结构示意图为
(3)元素③、④的简单氢化物的稳定性较弱的是
(4)元素①与②所形成的最简单有机物的空间结构是
(5)元素⑧的单质在空气中燃烧生成
您最近一年使用:0次
7 . 以菱锌矿(主要含有 ,另含有少量
,另含有少量 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有_______ (写出一种即可)。
(2)“调 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择_______ (填标号)。
A. B.
B. C.
C.
(3)“氧化过滤”中, 转化为
转化为 的离子方程式为
的离子方程式为_______ 。若反应结束时,溶液 为5,则残留的
为5,则残留的
_______  。
。
(4)“转化过滤”中,除去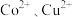 速率先慢后快的原因是
速率先慢后快的原因是_______ 。
(5)“脱钙镁过滤”后,溶液中
_______ 。
(6)“电解”装置示意如图。 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为_______ 。
②电解过程中,电解液中 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是_______ 。
 ,另含有少量
,另含有少量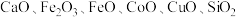 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图: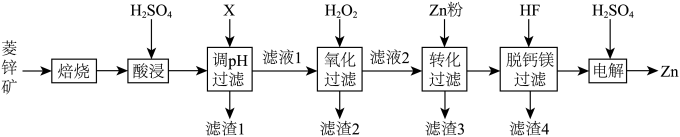
| 物质 |  |  |  |  |
 | 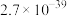 | 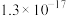 |  |  |
(2)“调
 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择A.
 B.
B. C.
C.
(3)“氧化过滤”中,
 转化为
转化为 的离子方程式为
的离子方程式为 为5,则残留的
为5,则残留的
 。
。(4)“转化过滤”中,除去
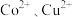 速率先慢后快的原因是
速率先慢后快的原因是(5)“脱钙镁过滤”后,溶液中

(6)“电解”装置示意如图。
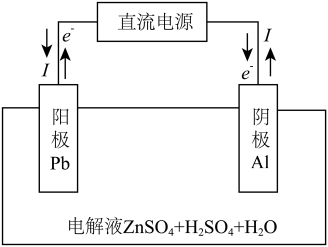
 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为②电解过程中,电解液中
 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是
您最近一年使用:0次
解题方法
8 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料等。 的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
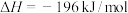 。回答下列问题:
。回答下列问题:
(1)已知 在
在 作用下的催化氧化历程如图所示反应
作用下的催化氧化历程如图所示反应

①的活化能为 ,反应②的活化能为
,反应②的活化能为 ,则
,则
_______  (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(2)当 、
、 、
、 (不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为
(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为 、
、 和
和 下,
下, 平衡转化率α随温度的变化如图所示。
平衡转化率α随温度的变化如图所示。

① 、
、 和
和 由小到大的顺序为
由小到大的顺序为_______ ,判断的依据是_______ 。
②在550℃、 条件下进行反应。平衡时,若
条件下进行反应。平衡时,若 转化率为α,则压强平衡常数Kp=
转化率为α,则压强平衡常数Kp=_______ 。(分压=总压×物质的量分数,用含α和 的代数式表示,不用写单位)
的代数式表示,不用写单位)
(3)以 为基础固硫材料,探究复合不同的催化剂(
为基础固硫材料,探究复合不同的催化剂( 、
、 -
- 、
、 -
- )在不同温度下催化
)在不同温度下催化 向
向 的转化效率(用单位时间
的转化效率(用单位时间 转化率表示)如图所示:
转化率表示)如图所示:

①仅使用 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是_______ 。
②下列有关说法正确的是_______
a.同温度下,三种催化剂中 催化剂效率最低
催化剂效率最低
b.温度越高一定越有利于催化剂催化效率的提升
c.同温同压下,使用复合催化剂有利于提高 的平衡产率
的平衡产率
d.催化剂通过改变反应历程,增大活化分子百分数,实现加快反应速率
(4)某 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: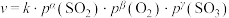 ,根据表中数据,γ=
,根据表中数据,γ=_______ 。
(5)利用 与
与 反应既可消除污染又可以制备
反应既可消除污染又可以制备 ,将含有
,将含有 尾气和一定比例的空气通入
尾气和一定比例的空气通入 悬浊液中,保持温度不变的情况下,测得溶液中
悬浊液中,保持温度不变的情况下,测得溶液中 和
和 随反应时间的变化如图所示。导致溶液中
随反应时间的变化如图所示。导致溶液中 和
和 的变化产生明显差异的原因是:
的变化产生明显差异的原因是:_______ 。

 的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
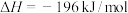 。回答下列问题:
。回答下列问题:(1)已知
 在
在 作用下的催化氧化历程如图所示反应
作用下的催化氧化历程如图所示反应
①的活化能为
 ,反应②的活化能为
,反应②的活化能为 ,则
,则
 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)(2)当
 、
、 、
、 (不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为
(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为 、
、 和
和 下,
下, 平衡转化率α随温度的变化如图所示。
平衡转化率α随温度的变化如图所示。
①
 、
、 和
和 由小到大的顺序为
由小到大的顺序为②在550℃、
 条件下进行反应。平衡时,若
条件下进行反应。平衡时,若 转化率为α,则压强平衡常数Kp=
转化率为α,则压强平衡常数Kp= 的代数式表示,不用写单位)
的代数式表示,不用写单位)(3)以
 为基础固硫材料,探究复合不同的催化剂(
为基础固硫材料,探究复合不同的催化剂( 、
、 -
- 、
、 -
- )在不同温度下催化
)在不同温度下催化 向
向 的转化效率(用单位时间
的转化效率(用单位时间 转化率表示)如图所示:
转化率表示)如图所示:
①仅使用
 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是②下列有关说法正确的是
a.同温度下,三种催化剂中
 催化剂效率最低
催化剂效率最低b.温度越高一定越有利于催化剂催化效率的提升
c.同温同压下,使用复合催化剂有利于提高
 的平衡产率
的平衡产率d.催化剂通过改变反应历程,增大活化分子百分数,实现加快反应速率
(4)某
 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: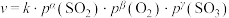 ,根据表中数据,γ=
,根据表中数据,γ=| 实验 |  |  |  | V |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 1.414q |
 与
与 反应既可消除污染又可以制备
反应既可消除污染又可以制备 ,将含有
,将含有 尾气和一定比例的空气通入
尾气和一定比例的空气通入 悬浊液中,保持温度不变的情况下,测得溶液中
悬浊液中,保持温度不变的情况下,测得溶液中 和
和 随反应时间的变化如图所示。导致溶液中
随反应时间的变化如图所示。导致溶液中 和
和 的变化产生明显差异的原因是:
的变化产生明显差异的原因是:
您最近一年使用:0次
9 . 硫元素广泛存在于自然界中,是动植物不可缺少的元素。SO2的生成及性质检验装置如图所示。

(1)SO2生成的化学方程式为__________ 。
(2)试管A中盛的试剂为品红溶液,可验证SO2的________ 。
(3)试管B中盛的试剂为________ ,可验证SO2酸性氧化物。
(4)设计实验,探究试管C溶液中的+4价硫元素是否被完全氧化。
可选用的试剂:酸性KMnO4溶液、H2O2溶液、KI溶液、FeC13溶液、淀粉溶液、Na2S溶液、Ba(OH)2溶液、BaCl2溶液、铁粉、稀硫酸、稀盐酸

(1)SO2生成的化学方程式为
(2)试管A中盛的试剂为品红溶液,可验证SO2的
(3)试管B中盛的试剂为
(4)设计实验,探究试管C溶液中的+4价硫元素是否被完全氧化。
可选用的试剂:酸性KMnO4溶液、H2O2溶液、KI溶液、FeC13溶液、淀粉溶液、Na2S溶液、Ba(OH)2溶液、BaCl2溶液、铁粉、稀硫酸、稀盐酸
序号 | 步骤 | 现象 | 结论 |
| ① | 取少量试管C中溶液,向其中滴加 | 溶液中存在+4价硫元素 | |
| ② | 取少量试管C中溶液,加入稀盐酸酸化,向其中滴加 | 溶液中存在 结合①,溶液中+4价硫元素部分被氧化 |
您最近一年使用:0次
10 . 下图表示各物质之间的转化关系。已知:常温下B、D、F、G、I、J是气体,F、G是空气中的主要成分,D是一种碱性气体;A中阴、阳离子个数比是 ,E是一种黑色氧化物,H是紫红色金属单质(部分生成物和反应条件省略)
,E是一种黑色氧化物,H是紫红色金属单质(部分生成物和反应条件省略)

请按要求回答下列问题:
(1)A物质是_______ ;X物质是_______ ;K物质是_______ (均写化学式)。
(2)反应③的化学方程式是_______ 。
(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是_______ 。
(4)反应②的化学反应方程式为_______ ;作氧化剂的是_______ 。
(5)某小组同学用如图所示装置制取氨,并探究其性质。

①大试管中发生的反应的化学方程式是_______ 。
②请将方框中的收集装置补充完整_______ ,解释采用这种收集方法的原因是_______ 。
③甲同学用如图所示的装置进行尾气处理,乙同学认为不合理,其理由是:_______ 。

 ,E是一种黑色氧化物,H是紫红色金属单质(部分生成物和反应条件省略)
,E是一种黑色氧化物,H是紫红色金属单质(部分生成物和反应条件省略)
请按要求回答下列问题:
(1)A物质是
(2)反应③的化学方程式是
(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是
(4)反应②的化学反应方程式为
(5)某小组同学用如图所示装置制取氨,并探究其性质。

①大试管中发生的反应的化学方程式是
②请将方框中的收集装置补充完整
③甲同学用如图所示的装置进行尾气处理,乙同学认为不合理,其理由是:

您最近一年使用:0次



