名校
解题方法
1 . 某实验兴趣小组同学用如图所示装置制备氢氧化铁胶体(部分夹持装置已略去)。根据所学知识回答下列问题:
已知:淀粉溶液遇到碘水会变蓝。

(1)仪器a的名称为_________ 。
(2)氢氧化铁胶体的制备:
①烧杯中发生反应的化学方程式为_________ ,该反应的反应类型为反应_________ (填基本反应类型)。
②证明有 胶体生成的方法是
胶体生成的方法是_________ 。
③下列关于氢氧化铁胶体的说法正确的是_________ (填序号)。
A.具有吸附性 B.单个氢氧化铁分子的直径大于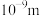
④向 胶体中逐滴加入过量稀硫酸,现象是
胶体中逐滴加入过量稀硫酸,现象是_________ 。
(3)如图所示是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。回答下列问题:
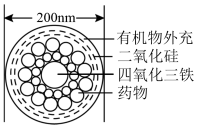
“纳米药物分子运输车”分散于水中所得的分散系___________ (填“属于”或“不属于”)胶体,这种分散系与其他分散系的本质区别为___________ 。
已知:淀粉溶液遇到碘水会变蓝。

(1)仪器a的名称为
(2)氢氧化铁胶体的制备:
①烧杯中发生反应的化学方程式为
②证明有
 胶体生成的方法是
胶体生成的方法是③下列关于氢氧化铁胶体的说法正确的是
A.具有吸附性 B.单个氢氧化铁分子的直径大于
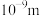
④向
 胶体中逐滴加入过量稀硫酸,现象是
胶体中逐滴加入过量稀硫酸,现象是(3)如图所示是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。回答下列问题:

“纳米药物分子运输车”分散于水中所得的分散系
您最近一年使用:0次
2023-08-23更新
|
695次组卷
|
2卷引用:云南省保山市高(完)中C、D类学校2022-2023学年高一上学期10月联考化学试题
名校
解题方法
2 . Ⅰ.如图是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。回答下列问题:
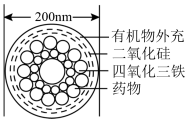
(1)“纳米药物分子运输车”分散于水中所得的分散系_______ (填“属于”或“不属于”)胶体。
(2)“纳米药物分子运输车”的外壳属于有机物。酒精、蔗糖、醋酸这三种有机物中,属于电解质的是_______ 。
(3)从元素组成的角度分析,CO2和Fe3O4可归为同一类物质,其类别属于化合物中的_______ 。
(4)纳米级的Fe3O4是一种非常重要的磁性材料。
①Fe3O4溶于稀盐酸生成FeCl3、_______ 和H2O。
②铁在氧气中燃烧生成Fe3O4,反应中每生成1 mol Fe3O4转移_______ mol电子。
Ⅱ.配制480 mL0.5 mol/L的NaOH溶液用于洗涤器物。
(5)配制时,应用天平称取NaOH的质量为_______ 。
某操作步骤如图所示:

该操作应放在如图所示的_______ (填序号)操作之间。

(6)下列说法错误的是_______(填字母)。

(1)“纳米药物分子运输车”分散于水中所得的分散系
(2)“纳米药物分子运输车”的外壳属于有机物。酒精、蔗糖、醋酸这三种有机物中,属于电解质的是
(3)从元素组成的角度分析,CO2和Fe3O4可归为同一类物质,其类别属于化合物中的
(4)纳米级的Fe3O4是一种非常重要的磁性材料。
①Fe3O4溶于稀盐酸生成FeCl3、
②铁在氧气中燃烧生成Fe3O4,反应中每生成1 mol Fe3O4转移
Ⅱ.配制480 mL0.5 mol/L的NaOH溶液用于洗涤器物。
(5)配制时,应用天平称取NaOH的质量为
某操作步骤如图所示:

该操作应放在如图所示的

(6)下列说法错误的是_______(填字母)。
| A.称量NaOH固体的时间不宜过长 |
| B.待烧杯中溶液冷却至室温才进行转移 |
| C.定容时,仰视容量瓶刻度线会使配制的NaOH溶液浓度偏高 |
| D.容量瓶可存放配好的NaOH溶液 |
您最近一年使用:0次
2022-12-12更新
|
176次组卷
|
3卷引用:福建省莆田第二十四中学2021-2022学年高一下学期开学摸底考试化学(1卷)试题
3 . 某实验兴趣小组同学进行胶体的制备及性质实验,回答下列问题。
I、氢氧化铁胶体的制备和性质
(1)图中仪器a的名称为___________ 。
(2)①设计实验证明获得了氢氧化铁胶体___________ 。
②烧杯中发生反应的化学方程式为___________ 。
II、AgI是难溶于水的黄色沉淀,在一定条件下也可以形成胶体。兴趣小组设计如下实验探究某种条件对AgI胶体粒子所带电性的影响:
实验①:将稀AgNO3溶液逐滴加入过量的稀KI溶液中,得到AgI胶体I;
实验②:将稀KI溶液逐滴加入过量的稀AgNO3溶液中,得到AgI胶体II;
实验③:将提纯后的AgI胶体I与AgI胶体II进行混合,出现了黄色沉淀。
完成下列填空:
(3)写出制备AgI胶体I的离子方程式___________ 。
(4)提纯AI胶体的方法如图所示。
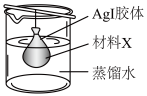
材料X为___________ 。用该法提纯AgI胶体II,进入蒸馏水中而被除去的离子有___________ (写离子符号,写三种)。
(5)本实验的探究结论是制备AgI胶体时反应物的用量对胶体粒子所带电性___________ (选填“有”或“无”)影响。简述作出此判断的理由___________ 。
I、氢氧化铁胶体的制备和性质
(1)图中仪器a的名称为

(2)①设计实验证明获得了氢氧化铁胶体
②烧杯中发生反应的化学方程式为
II、AgI是难溶于水的黄色沉淀,在一定条件下也可以形成胶体。兴趣小组设计如下实验探究某种条件对AgI胶体粒子所带电性的影响:
实验①:将稀AgNO3溶液逐滴加入过量的稀KI溶液中,得到AgI胶体I;
实验②:将稀KI溶液逐滴加入过量的稀AgNO3溶液中,得到AgI胶体II;
实验③:将提纯后的AgI胶体I与AgI胶体II进行混合,出现了黄色沉淀。
完成下列填空:
(3)写出制备AgI胶体I的离子方程式
(4)提纯AI胶体的方法如图所示。

材料X为
(5)本实验的探究结论是制备AgI胶体时反应物的用量对胶体粒子所带电性
您最近一年使用:0次
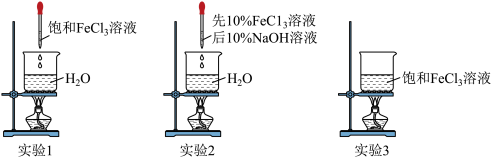
4 . 实验小组探究 胶体的制备方法及其性质。
胶体的制备方法及其性质。
Ⅰ.制备 胶体
胶体
(1)实验1,生成 胶体和
胶体和_______ (填化学式)。
(2)实验2与实验1对比,优点是_______ (写出1条即可)。
(3)综合上述实验:制备 胶体提供
胶体提供 的物质可以是
的物质可以是 或
或_______ ,控制反应条件即可制得。
Ⅱ. 胶体的性质
胶体的性质
(4)下列关于 胶体和
胶体和 悬浊液的描述,正确的是_______
悬浊液的描述,正确的是_______
(5)将 胶体置于U型管中,通直流电一段时间,观察到
胶体置于U型管中,通直流电一段时间,观察到_______ 极附近颜色变深,说明_______ 。
资料:
Ⅰ.pH>10时, 胶体溶解。
胶体溶解。
Ⅱ.固体 易升华。
易升华。
实验4取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体 。
。
(6)根据资料,推测漏斗内棕褐色的烟中主要含有_______ (填化学式)。
研究表明: 胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
(7)不同pH时,测得溶液中 胶体对砷酸的吸附效率如图。
胶体对砷酸的吸附效率如图。
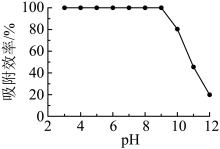
pH为3~9时, 胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是
胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是_______ 。
(8)去除水中高浓度砷酸的原理是 胶体与砷酸反应生成砷酸铁(
胶体与砷酸反应生成砷酸铁( )沉淀,化学方程式是
)沉淀,化学方程式是_______ 。
 胶体的制备方法及其性质。
胶体的制备方法及其性质。
Ⅰ.制备
 胶体
胶体| 实验 | 实验操作 | 丁达尔效应 |
| 1 | 向40mL沸腾的蒸馏水中滴入5滴饱和 溶液(浓度约为30%) 溶液(浓度约为30%) | 迅速出现 |
| 2 | 向40mL蒸馏水中滴入5滴10% 溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 | 迅速出现 |
| 3 | 加热40mL饱和 溶液 溶液 | 一段时间后出现 |
 胶体和
胶体和(2)实验2与实验1对比,优点是
(3)综合上述实验:制备
 胶体提供
胶体提供 的物质可以是
的物质可以是 或
或Ⅱ.
 胶体的性质
胶体的性质(4)下列关于
 胶体和
胶体和 悬浊液的描述,正确的是_______
悬浊液的描述,正确的是_______| A.两者颜色相同 | B.两者稳定性相同 |
| C.两者的分散质直径均大于100nm | D.滴加稀盐酸后,两者现象完全相同 |
 胶体置于U型管中,通直流电一段时间,观察到
胶体置于U型管中,通直流电一段时间,观察到资料:
Ⅰ.pH>10时,
 胶体溶解。
胶体溶解。Ⅱ.固体
 易升华。
易升华。实验4取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体
 。
。(6)根据资料,推测漏斗内棕褐色的烟中主要含有
研究表明:
 胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。(7)不同pH时,测得溶液中
 胶体对砷酸的吸附效率如图。
胶体对砷酸的吸附效率如图。
pH为3~9时,
 胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是
胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是(8)去除水中高浓度砷酸的原理是
 胶体与砷酸反应生成砷酸铁(
胶体与砷酸反应生成砷酸铁( )沉淀,化学方程式是
)沉淀,化学方程式是
您最近一年使用:0次
2022-11-08更新
|
310次组卷
|
3卷引用:上海市上海中学2022-2023学年高一上学期期中考试化学试题
上海市上海中学2022-2023学年高一上学期期中考试化学试题新疆塔城地区第二中学2022-2023学年高三上学期11月月考化学(A)试题(已下线)专题01 物质的分类-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(上海专用)
名校
解题方法
5 . FeCl3溶液和氢氧化铁胶体颜色相近,某同学按照以下操作步骤进行实验探究二者的性质。
(1)向少量红棕色的Fe2O3粉末,加入适量盐酸,发生反应的化学方程式为:____ ,反应后得到的溶液呈____ 色。
(2)取少量上述溶液于试管中,滴入几滴NaOH溶液,可观察到____ 的现象,反应的化学方程式为____ ,此反应属于____ (填写反应基本类型)。
(3)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈____ 色,即制得Fe(OH)3胶体。该实验不能用自来水的原因是____ 。
(4)取另一只盛有20mL蒸馏水的小烧杯,向其中加入1mLFeCl3溶液,振荡均匀后,与制得的Fe(OH)3胶体一起放置于暗处,分别用激光笔照射烧杯中的液体,可以观察到____ 。
(5)取(3)中制得的Fe(OH)3胶体进行以下实验:
①将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,说明____ ,这种现象称为____ 。
②向Fe(OH)3胶体中逐滴滴加过量稀盐酸,边滴边振荡,观察到____ ,写出反应的化学方程式为:_____ 。
(1)向少量红棕色的Fe2O3粉末,加入适量盐酸,发生反应的化学方程式为:
(2)取少量上述溶液于试管中,滴入几滴NaOH溶液,可观察到
(3)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈
(4)取另一只盛有20mL蒸馏水的小烧杯,向其中加入1mLFeCl3溶液,振荡均匀后,与制得的Fe(OH)3胶体一起放置于暗处,分别用激光笔照射烧杯中的液体,可以观察到
(5)取(3)中制得的Fe(OH)3胶体进行以下实验:
①将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,说明
②向Fe(OH)3胶体中逐滴滴加过量稀盐酸,边滴边振荡,观察到
您最近一年使用:0次
解题方法
6 . 将少量饱和 溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和 溶液滴加到冷水中;乙:饱和
溶液滴加到冷水中;乙:饱和 溶液滴加到
溶液滴加到 溶液中;
溶液中;
丙:饱和 溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
(1)以上三种操作得到的分散系中,分散质粒子直径最大的是_______ (填甲、乙、丙),名称是_______ ,乙中实验现象是:_______ 。
(2)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为_______ 。
(3)判断丙中成功制备胶体的操作方法是_______ (描述操作过程)。
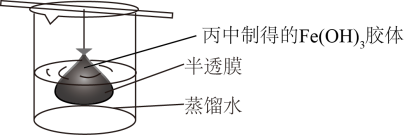
(4)可用如图所示的装置除去 胶体中的杂质离子来提纯
胶体中的杂质离子来提纯 胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入
胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入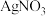 溶液,若
溶液,若_______ (填实验现象),则说明该 胶体中的杂质离子已经完全除去。
胶体中的杂质离子已经完全除去。
 溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:甲:饱和
 溶液滴加到冷水中;乙:饱和
溶液滴加到冷水中;乙:饱和 溶液滴加到
溶液滴加到 溶液中;
溶液中;丙:饱和
 溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。(1)以上三种操作得到的分散系中,分散质粒子直径最大的是
(2)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为
(3)判断丙中成功制备胶体的操作方法是
(4)可用如图所示的装置除去
 胶体中的杂质离子来提纯
胶体中的杂质离子来提纯 胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入
胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入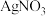 溶液,若
溶液,若 胶体中的杂质离子已经完全除去。
胶体中的杂质离子已经完全除去。
您最近一年使用:0次
7 . 某课外活动小组进行 胶体的制备实验并检验其相关性质。
胶体的制备实验并检验其相关性质。
(1)若将饱和 溶液分别滴入下列物质中,能形成胶体的是
溶液分别滴入下列物质中,能形成胶体的是___________ 。
A.冷水
B.沸水
C.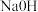 浓溶液D.
浓溶液D. 浓溶液
浓溶液
(2)写出制备 胶体的化学反应方程式
胶体的化学反应方程式___________ 。
(3)取少量制得的胶体加入试管中,再加入少量 溶液,观察到的现象是
溶液,观察到的现象是___________
(4) 胶体区别于
胶体区别于 溶液最本质的特征是___________。
溶液最本质的特征是___________。
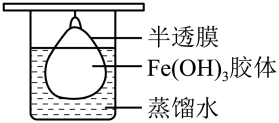
(5)将制得的胶体放入半透膜制成的袋内,如图所示,放置 后,取少量半透膜外的液体于试管中,向试管中加入硝酸银溶液,再滴加稀硝酸,可观察到的现象为
后,取少量半透膜外的液体于试管中,向试管中加入硝酸银溶液,再滴加稀硝酸,可观察到的现象为___________ 。
 胶体的制备实验并检验其相关性质。
胶体的制备实验并检验其相关性质。(1)若将饱和
 溶液分别滴入下列物质中,能形成胶体的是
溶液分别滴入下列物质中,能形成胶体的是A.冷水
B.沸水
C.
 浓溶液D.
浓溶液D. 浓溶液
浓溶液(2)写出制备
 胶体的化学反应方程式
胶体的化学反应方程式(3)取少量制得的胶体加入试管中,再加入少量
 溶液,观察到的现象是
溶液,观察到的现象是(4)
 胶体区别于
胶体区别于 溶液最本质的特征是___________。
溶液最本质的特征是___________。A. 胶体粒子的直径在 胶体粒子的直径在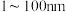 之间 之间 |
B. 胶体具有丁达尔效应 胶体具有丁达尔效应 |
C. 胶体是均一的分散系 胶体是均一的分散系 |
D. 胶体的分散质粒子能透过滤纸 胶体的分散质粒子能透过滤纸 |
 后,取少量半透膜外的液体于试管中,向试管中加入硝酸银溶液,再滴加稀硝酸,可观察到的现象为
后,取少量半透膜外的液体于试管中,向试管中加入硝酸银溶液,再滴加稀硝酸,可观察到的现象为
您最近一年使用:0次
2022-10-09更新
|
297次组卷
|
2卷引用:湖南省邵阳市第二中学2022-2023学年高一上学期第一次月考化学试题
解题方法
8 . 通过如图装置完成氢氧化铁胶体的制备及性质实验。
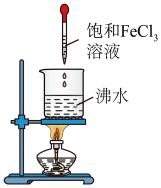
①向沸水中加入几滴饱和FeCl3溶液,继续煮沸至液体呈红褐色停止加热。
②把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,用红色激光笔照射两烧杯中的液体,观察现象。
(1)图中盛有饱和FeCl3溶液的仪器名称为____ 。
(2)Fe(OH)3胶体____ (填“能”或“不能”)透过滤纸,请写出制备Fe(OH)3胶体的化学方程式:___ 。
(3)步骤②中能观察到的现象为____ ,胶体产生的现象称为____ 。胶体与其他分散系不同的根本原因是____ 。
(4)若将实验改为向饱和FeCl3溶液中加入NaOH溶液,则观察到的现象为____ ,该反应的化学方程式为____ 。

①向沸水中加入几滴饱和FeCl3溶液,继续煮沸至液体呈红褐色停止加热。
②把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,用红色激光笔照射两烧杯中的液体,观察现象。
(1)图中盛有饱和FeCl3溶液的仪器名称为
(2)Fe(OH)3胶体
(3)步骤②中能观察到的现象为
(4)若将实验改为向饱和FeCl3溶液中加入NaOH溶液,则观察到的现象为
您最近一年使用:0次
2022-08-17更新
|
2168次组卷
|
3卷引用:第一节 物质的分类及转化 第1课时 物质的分类及其应用
9 . 实验室产生的酸性废液中含有Fe3+、Cu2+两种金属离子,某同学设计了如图所示方案对废液进行处理来回收金属,保护环境。
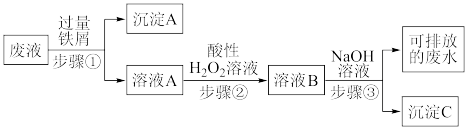
(1)沉淀A的成分是:_____ (写化学式),若步骤①中加入少量铁屑,无沉淀生成,此时发生反应的离子方程式为____ 。
(2)如何检验溶液A中的金属阳离子,简述其方法:_____ 。
(3)写出步骤②发生反应的化学方程式:_____ 。
(4)步骤③的操作名称是____ ,用到的主要玻璃仪器有烧杯、____ ,沉淀C与胶体C的本质区别是:____ 。

(1)沉淀A的成分是:
(2)如何检验溶液A中的金属阳离子,简述其方法:
(3)写出步骤②发生反应的化学方程式:
(4)步骤③的操作名称是
您最近一年使用:0次
21-22高一上·河南南阳·阶段练习
名校
解题方法
10 . 取一定量Fe2O3粉末(红棕色)加入适量某浓度的盐酸中,得到呈棕黄色的饱和FeCl3溶液,利用此溶液进行以下实验:
(1)写出生成此溶液所发生反应的化学方程式为___________ 。
(2)取少量该FeCl3溶液置于试管甲中,滴入NaOH溶液,可以观察到有红褐色沉淀生成,反应的化学方程式为___________ ,此反应属于___________ (填基本反应类型)。
(3)在小烧杯甲中加入25mL蒸馏水,加热至沸腾后,向___________ 中加入2mL___________ ,继续煮沸至溶液呈___________ 色,即可制得Fe(OH)3胶体,反应方程式为___________ 。
(4)另取一小烧杯乙加入25mL蒸馏水,然后再加入2mL该FeCl3溶液,振荡均匀,将乙烧杯与另一盛有Fe(OH)3胶体的丙烧杯一起放置在暗处,分别用红色激光笔照射烧杯中的液体,可以看到___________ (填“乙”或“丙”)烧杯中产生丁达尔效应。用这个实验可以区别___________ 。
(5)取丙烧杯中的少量Fe(OH)3胶体置于试管乙中,向试管乙中滴加一定量的稀硫酸,边滴加边振荡,在此过程中可看到试管乙中生成的红褐色沉淀逐渐溶解,最终又得到棕黄色的溶液,发生此变化的化学方程式为___________ 。
(6)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是___________。
(7)制得的Fe(OH)3胶体中往往混有H+和Cl-,可以利用___________ (方法)来提纯Fe(OH)3胶体。证明Fe(OH)3胶体和Cl-已分离完全的实验操作是___________ 。
(1)写出生成此溶液所发生反应的化学方程式为
(2)取少量该FeCl3溶液置于试管甲中,滴入NaOH溶液,可以观察到有红褐色沉淀生成,反应的化学方程式为
(3)在小烧杯甲中加入25mL蒸馏水,加热至沸腾后,向
(4)另取一小烧杯乙加入25mL蒸馏水,然后再加入2mL该FeCl3溶液,振荡均匀,将乙烧杯与另一盛有Fe(OH)3胶体的丙烧杯一起放置在暗处,分别用红色激光笔照射烧杯中的液体,可以看到
(5)取丙烧杯中的少量Fe(OH)3胶体置于试管乙中,向试管乙中滴加一定量的稀硫酸,边滴加边振荡,在此过程中可看到试管乙中生成的红褐色沉淀逐渐溶解,最终又得到棕黄色的溶液,发生此变化的化学方程式为
(6)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是___________。
| A.Fe(OH)3胶体粒子的直径在1~100nm之间 |
| B.Fe(OH)3胶体具有丁达尔效应 |
| C.Fe(OH)3胶体是均一的分散系 |
| D.Fe(OH)3胶体的分散质能透过滤纸 |
您最近一年使用:0次
2021-10-25更新
|
331次组卷
|
5卷引用:第03练 物质的分散系 电解质-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)
(已下线)第03练 物质的分散系 电解质-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)(已下线)衔接点04 分散系 胶体-2022年初升高化学无忧衔接河南省开封市杞县高中2022-2023学年高一上学期月考化学试题河南省南阳市第一中学校2021-2022学年高一上学期第一次月考试题化学试题河南省郑州市第十二中学2021-2022学年高一上学期第一次月考化学试题



