名校
解题方法
1 . (1)下列四种物质,①NA个HCl ②24gCH4 ③4.816×1023个H2O2分子 ④10.8mL水(密度为1g·cm-3)。
ⅰ.四种物质所含分子数由多到少的顺序是:_________________________________ ;
ⅱ.四种物质所含原子数由多到少的顺序是:_________________________________ ;
ⅲ.四种物质所含H由多到少的顺序是:_____________________________________ ;
ⅳ.四种物质的质量由多到少的顺序是:_____________________________________ 。
(2)H2O与CO2的质量比为18:22,则H2O和CO2的物质的量之比为________ ,分子个数比为_______ ,原子个数比为__________ ,所含氧原子个数比为___________ 。
(3)在标准状况下,等质量的O3和CO2比较,密度比为________ ,分子数之比为_________ ,原子数之比为______ ,体积比为_______ ,物质的量之比为__________ 。
(4)CH4与H2的混合气体,其质量百分含量分别为80%、20%,则混合气体的平均相对分子质量为__________ 。
(5)标准状况下,某气体密度为1.96g/L,则该气体的摩尔质量为_____ (保留整数)。
(6)把100克某NaOH溶液(密度是1.22g/cm3)蒸发浓缩,余下溶液50ml时,物质的量浓度是8mol/L,原溶液的物质的量浓度是_________________ 。
(7)已知Na2S、Na2SO3、Na2SO4混合物中硫元素的质量分数为a%,则氧元素的质量分数为_____________ 。
ⅰ.四种物质所含分子数由多到少的顺序是:
ⅱ.四种物质所含原子数由多到少的顺序是:
ⅲ.四种物质所含H由多到少的顺序是:
ⅳ.四种物质的质量由多到少的顺序是:
(2)H2O与CO2的质量比为18:22,则H2O和CO2的物质的量之比为
(3)在标准状况下,等质量的O3和CO2比较,密度比为
(4)CH4与H2的混合气体,其质量百分含量分别为80%、20%,则混合气体的平均相对分子质量为
(5)标准状况下,某气体密度为1.96g/L,则该气体的摩尔质量为
(6)把100克某NaOH溶液(密度是1.22g/cm3)蒸发浓缩,余下溶液50ml时,物质的量浓度是8mol/L,原溶液的物质的量浓度是
(7)已知Na2S、Na2SO3、Na2SO4混合物中硫元素的质量分数为a%,则氧元素的质量分数为
您最近一年使用:0次
名校
2 . 向蔗糖(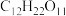 )中滴入98%的浓硫酸,蔗糖会变成疏松的“炭块”,同时产生
)中滴入98%的浓硫酸,蔗糖会变成疏松的“炭块”,同时产生 ,
, ;
; 可用酸性高锰酸钾溶液吸收。请回答下列问题:
可用酸性高锰酸钾溶液吸收。请回答下列问题:
(1)蔗糖的摩尔质量为______ 。17.1 g 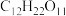 的物质的量为
的物质的量为______ 。
(2)500℃时,34.2 g蔗糖完全燃烧,产生两种气体的体积之比为______ ,其中产生 的体积(折算成标准状况下)为
的体积(折算成标准状况下)为______ L。
(3)质量分数为98%、密度为1.84 g⋅cm 的浓硫酸的物质的量浓度为
的浓硫酸的物质的量浓度为______ mol·L ;酸性高锰酸钾溶液需要用浓度为3 mol⋅L
;酸性高锰酸钾溶液需要用浓度为3 mol⋅L 的硫酸酸化,则实验室配制50 mL该浓度的硫酸需质量分数为98%的浓硫酸
的硫酸酸化,则实验室配制50 mL该浓度的硫酸需质量分数为98%的浓硫酸______ mL,需要用到的定量仪器有______ 。
(4) 被酸性高锰酸钾溶液吸收发生反应的离子方程式为
被酸性高锰酸钾溶液吸收发生反应的离子方程式为______ 。
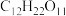 )中滴入98%的浓硫酸,蔗糖会变成疏松的“炭块”,同时产生
)中滴入98%的浓硫酸,蔗糖会变成疏松的“炭块”,同时产生 ,
, ;
; 可用酸性高锰酸钾溶液吸收。请回答下列问题:
可用酸性高锰酸钾溶液吸收。请回答下列问题:(1)蔗糖的摩尔质量为
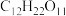 的物质的量为
的物质的量为(2)500℃时,34.2 g蔗糖完全燃烧,产生两种气体的体积之比为
 的体积(折算成标准状况下)为
的体积(折算成标准状况下)为(3)质量分数为98%、密度为1.84 g⋅cm
 的浓硫酸的物质的量浓度为
的浓硫酸的物质的量浓度为 ;酸性高锰酸钾溶液需要用浓度为3 mol⋅L
;酸性高锰酸钾溶液需要用浓度为3 mol⋅L 的硫酸酸化,则实验室配制50 mL该浓度的硫酸需质量分数为98%的浓硫酸
的硫酸酸化,则实验室配制50 mL该浓度的硫酸需质量分数为98%的浓硫酸(4)
 被酸性高锰酸钾溶液吸收发生反应的离子方程式为
被酸性高锰酸钾溶液吸收发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 物质的量是一个联系宏观和微观的重要物理量。请回答下列有关问题。
(1)同温同压下,A2气体与B2气体化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为___________ 。
(2)已知 的电子数为a,M的质量数为A,则2 mol的M的中子数为
的电子数为a,M的质量数为A,则2 mol的M的中子数为___________ 。
(3)质量之比为16∶7∶6的三种气体SO2、CO、NO。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(4)稀硫酸与铝恰好完全反应,所得V mL Al2(SO4)3溶液中含有m g Al3+,则该溶液中 物质的量浓度为
物质的量浓度为___________ mol·L-1。
(5)标准状况下,将体积比为9∶1∶4的H2、Cl2、O2在密闭容器中用电火花点燃充分反应,恢复到原状态后,形成溶液的质量分数为___________ 。(保留三位小数)
(1)同温同压下,A2气体与B2气体化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为
(2)已知
 的电子数为a,M的质量数为A,则2 mol的M的中子数为
的电子数为a,M的质量数为A,则2 mol的M的中子数为(3)质量之比为16∶7∶6的三种气体SO2、CO、NO。分子个数之比为
(4)稀硫酸与铝恰好完全反应,所得V mL Al2(SO4)3溶液中含有m g Al3+,则该溶液中
 物质的量浓度为
物质的量浓度为(5)标准状况下,将体积比为9∶1∶4的H2、Cl2、O2在密闭容器中用电火花点燃充分反应,恢复到原状态后,形成溶液的质量分数为
您最近一年使用:0次
名校
4 . 物质的量是高中化学中常用的物理量,请完成以下有关其内容的计算:
(1)标准状况下,含有相同氧原子数的CO与CO2的体积之比为___________ 。
(2)等温等压下,等体积的O2和O3所含分子个数比为___________ ,原子个数比为___________ ,质量比为___________ 。
(3)设NA为阿伏加德罗常数的数值,如果a g某气中含有的分子数为b,则c g某气在标准状况下的体积约是___________ 。 (用含NA的式子表示)。
(4)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为___________ mL。
(5)100 mL 某Al2(SO4)3溶液中,n(Al3+)=0.20 mol,则其中c(SO )=
)= ___________ mol/L。
(1)标准状况下,含有相同氧原子数的CO与CO2的体积之比为
(2)等温等压下,等体积的O2和O3所含分子个数比为
(3)设NA为阿伏加德罗常数的数值,如果a g某气中含有的分子数为b,则c g某气在标准状况下的体积约是
(4)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为
(5)100 mL 某Al2(SO4)3溶液中,n(Al3+)=0.20 mol,则其中c(SO
 )=
)=
您最近一年使用:0次
名校
解题方法
5 . 金粉溶于过氧化氢-浓盐酸可以安全环保的制备氯金酸(H[AuCl4]),其化学方程式为: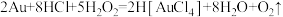 。设NA为阿伏加德罗常数的值,下列说法正确的是
。设NA为阿伏加德罗常数的值,下列说法正确的是
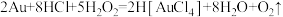 。设NA为阿伏加德罗常数的值,下列说法正确的是
。设NA为阿伏加德罗常数的值,下列说法正确的是| A.消耗1 mol Au,反应转移的电子数为4NA |
| B.100 mL质量分数为36.5%、密度为1.19 g/cm3的盐酸中所含HCl的分子数为1.19NA |
| C.消耗85 g H2O2,产物中形成的配位键数目为2NA |
| D.2 mol液态水中含有的氢键数目为4NA |
您最近一年使用:0次
名校
解题方法
6 . 乙醇俗称酒精,分子式为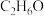 ,常温常压下是一种无色易挥发的液体,能与水以任意比例互溶。乙醇完全燃烧时发生反应:
,常温常压下是一种无色易挥发的液体,能与水以任意比例互溶。乙醇完全燃烧时发生反应: ;不完全燃烧时会有CO生成。请回答下列问题:
;不完全燃烧时会有CO生成。请回答下列问题:
(1)0.5mol 与
与_______ g  含有的氧原子数相同。
含有的氧原子数相同。
(2)同温同压下,同体积的 和CO的物质的量之比为
和CO的物质的量之比为_______ ,质量之比为_______
(3)乙醇完全燃烧时,每消耗9.6g ,生成
,生成 的体积为
的体积为_______ L(标准状况下)。
(4)将23g乙醇溶于一定量的水中配制成500mL乙醇溶液(密度为 ),则该溶液的物质的量浓度为
),则该溶液的物质的量浓度为_______ 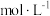 ,质量分数为
,质量分数为_______ %。
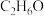 ,常温常压下是一种无色易挥发的液体,能与水以任意比例互溶。乙醇完全燃烧时发生反应:
,常温常压下是一种无色易挥发的液体,能与水以任意比例互溶。乙醇完全燃烧时发生反应: ;不完全燃烧时会有CO生成。请回答下列问题:
;不完全燃烧时会有CO生成。请回答下列问题:(1)0.5mol
 与
与 含有的氧原子数相同。
含有的氧原子数相同。(2)同温同压下,同体积的
 和CO的物质的量之比为
和CO的物质的量之比为(3)乙醇完全燃烧时,每消耗9.6g
 ,生成
,生成 的体积为
的体积为(4)将23g乙醇溶于一定量的水中配制成500mL乙醇溶液(密度为
 ),则该溶液的物质的量浓度为
),则该溶液的物质的量浓度为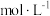 ,质量分数为
,质量分数为
您最近一年使用:0次
2022-11-17更新
|
180次组卷
|
2卷引用:贵州省部分学校2022-2023学年高一上学期期中联合考试化学试题
名校
解题方法
7 . 根据要求进行计算。
(1)某含氯化合物X在标准状况下为气体,7.3gX在标准状况下的体积为4.48L,则X的摩尔质量是_______ 。
(2)室温下,某容积固定的密闭容器由可移动的挡板(厚度可忽略)隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。
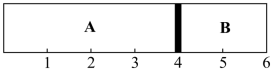
①A室混合气体的物质的量为_______ 。
②实验测得A室混合气体的质量为34 g,若将A室H2、O2的混合气体点燃,恢复原温度后,最终挡板停留的位置在_______ 刻度,容器内气体压强与反应前气体压强之比为_______ 。
(3)1774年瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10 mol/L的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400 mL。(已知Mn的相对原子质量为55)
MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10 mol/L的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400 mL。(已知Mn的相对原子质量为55)
①生成的氯气在标况下的体积_______ 。
②稀释后溶液中MnCl2的物质的量浓度_______ 。
(1)某含氯化合物X在标准状况下为气体,7.3gX在标准状况下的体积为4.48L,则X的摩尔质量是
(2)室温下,某容积固定的密闭容器由可移动的挡板(厚度可忽略)隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。

①A室混合气体的物质的量为
②实验测得A室混合气体的质量为34 g,若将A室H2、O2的混合气体点燃,恢复原温度后,最终挡板停留的位置在
(3)1774年瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合制氯气:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10 mol/L的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400 mL。(已知Mn的相对原子质量为55)
MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10 mol/L的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400 mL。(已知Mn的相对原子质量为55)①生成的氯气在标况下的体积
②稀释后溶液中MnCl2的物质的量浓度
您最近一年使用:0次
2022-10-03更新
|
211次组卷
|
2卷引用:山东省潍坊高密市第三中学2022-2023学年高一9月月考化学试题
名校
解题方法
8 . 固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是
| A.两种单质的摩尔质量比为1∶3 | B.生成物C中A、B的原子个数比为3∶1 |
| C.生成物C中B的质量分数为25% | D.反应前后气体分子数比为1∶4 |
您最近一年使用:0次
2021高一·全国·专题练习
9 . 19世纪中期,某化学家为了测定元素X的摩尔质量而选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定了每种化合物中X的质量分数。在250℃时,四种化合物都是气态。将它们分别转移至预先抽成真空的四个等容积的烧瓶中,直至每个烧瓶内的压强达到1.013×105Pa。称每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量。用氮气重复这一过程,得到如下数据表。
请通过计算后确定元素X可能的摩尔质量(要求写出推算过程)_____ 。
| 气体 | 气体的质量/g | 气体中X元素的质量分数/% |
| N2 | 0.652 | — |
| A | 0.849 | 97.4 |
| B | 2.398 | 68.9 |
| C | 4.851 | 85.1 |
| D | 3.583 | 92.2 |
请通过计算后确定元素X可能的摩尔质量(要求写出推算过程)
您最近一年使用:0次
解题方法
10 . 简要回答或计算。
(1)Bi2Cl 离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型
离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型______ 。
(2)在液氨中,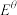 (Na+/Na)=-1.89V,
(Na+/Na)=-1.89V,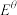 (Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因
(Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因_______ 。
(3)将Pb加到氨基钠的液氨溶液中,先生成白色沉淀Na4Pb,随后转化为Na4Pb9(绿色)而溶解。在此溶液中插入两块铅电极,通直流电,当1.0mol电子通过电解槽时,在哪个电极(阴极或阳极)上沉积出铅____ ?写出沉积铅的量____ 。
(4)下图是某金属氧化物的晶体结构示意图。图中,小球代表金属原子,大球代表氧原子,细线框处是其晶胞。
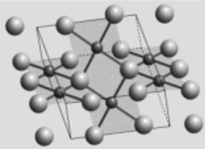
①写出金属原子的配位数(m)和氧原子的配位数(n):_______ 。
②写出晶胞中金属原子数(p)和氧原子数(q):________ 。
③写出该金属氧化物的化学式(金属用M表示)__________ 。
(5)向含[cis-Co(NH3)4(H2O)2]3+的溶液中加入氨水,析出含{Co[Co(NH3)4(OH)2]3}6+的难溶盐。{Co[Co(NH3)4(OH)2]3}6+是以羟基为桥键的多核络离子,具有手性。画出其结构____________ 。
(6)向K2Cr2O7和NaCl的混合物中加入浓硫酸制得化合物X(154.9g·mol-1)。X为暗红色液体,沸点117°C,有强刺激性臭味,遇水冒白烟,遇硫燃烧。X分子有两个相互垂直的镜面,两镜面的交线为二重旋转轴。写出X的化学式并画出其结构式___________ 。
(7)实验得到一种含钯化合物Pd[CxHyNz](ClO4)2,该化合物中C和H的质量分数分别为30.15%和5.06%。将此化合物转化为硫氰酸盐Pd[CxHyNz](SCN)2,则C和H的质量分数分别为40.46%和5.94%。通过计算确定Pd[CxHyNz](ClO4)2的组成___________ 。
(8)甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键。甲烷与空气按一定比例混合,氧气的利用率为85%,计算汽车尾气中O2、CO2、H2O和N2的体积比________ 。(空气中O2和N2体积比按21:79计;设尾气中CO2的体积为1)。
(1)Bi2Cl
 离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型
离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型(2)在液氨中,
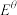 (Na+/Na)=-1.89V,
(Na+/Na)=-1.89V,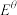 (Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因
(Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因(3)将Pb加到氨基钠的液氨溶液中,先生成白色沉淀Na4Pb,随后转化为Na4Pb9(绿色)而溶解。在此溶液中插入两块铅电极,通直流电,当1.0mol电子通过电解槽时,在哪个电极(阴极或阳极)上沉积出铅
(4)下图是某金属氧化物的晶体结构示意图。图中,小球代表金属原子,大球代表氧原子,细线框处是其晶胞。

①写出金属原子的配位数(m)和氧原子的配位数(n):
②写出晶胞中金属原子数(p)和氧原子数(q):
③写出该金属氧化物的化学式(金属用M表示)
(5)向含[cis-Co(NH3)4(H2O)2]3+的溶液中加入氨水,析出含{Co[Co(NH3)4(OH)2]3}6+的难溶盐。{Co[Co(NH3)4(OH)2]3}6+是以羟基为桥键的多核络离子,具有手性。画出其结构
(6)向K2Cr2O7和NaCl的混合物中加入浓硫酸制得化合物X(154.9g·mol-1)。X为暗红色液体,沸点117°C,有强刺激性臭味,遇水冒白烟,遇硫燃烧。X分子有两个相互垂直的镜面,两镜面的交线为二重旋转轴。写出X的化学式并画出其结构式
(7)实验得到一种含钯化合物Pd[CxHyNz](ClO4)2,该化合物中C和H的质量分数分别为30.15%和5.06%。将此化合物转化为硫氰酸盐Pd[CxHyNz](SCN)2,则C和H的质量分数分别为40.46%和5.94%。通过计算确定Pd[CxHyNz](ClO4)2的组成
(8)甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键。甲烷与空气按一定比例混合,氧气的利用率为85%,计算汽车尾气中O2、CO2、H2O和N2的体积比
您最近一年使用:0次



