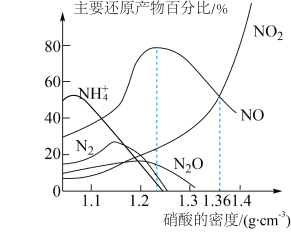
1 . 锌与不同密度的硝酸反应时,主要还原产物的百分比与硝酸的密度的关系如图所示。下列说法正确的是(已知:常温下,50%的硝酸密度约为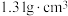 )
)
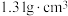 )
)
| A.氮与氧只能形成三种氧化物 |
B.锌与密度为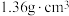 的硝酸反应时,n(消耗 的硝酸反应时,n(消耗 )∶n(消耗 )∶n(消耗 ) )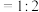 |
C.常温下,50%的硝酸的物质的量浓度约为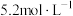 |
D.还原产物中 的百分比随硝酸密度增大而升高 的百分比随硝酸密度增大而升高 |
您最近一年使用:0次
2022-12-21更新
|
116次组卷
|
2卷引用:陕西省商洛市2022-2023学年高三上学期12月联考化学试题
2 . 从2 mol·L-1的氯化铜溶液中取出含3.55 g Cl-的未知质量溶液,所取未知质量溶液的体积是
| A.25 mL | B.50 mL |
| C.12.5 mL | D.7.5 mL |
您最近一年使用:0次
3 . 根据所学知识回答问题
(1)___________ molH2O中所含有的氧原子数与1.5 molCO2的氧原子数相同。
(2)质量为9.8g的H2SO4物质的量是___________ 。
(3)1.204×1024个H2的物质的量是___________ 。
(4)配制溶液时,称量5.85gNaCl固体,配制480mL溶液,则溶液物质的量浓度是___________ mol/L。
(5)标准状况下16gH2的体积是___________ L。
(6)100mL0.2mol·L-1的Na2SO4溶液中,取出10mL该溶液,c(Na+)=___________ ,将该10mL溶液加水稀释至100mL,则c( )=
)=___________ 。
(7)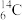 的中子数是
的中子数是___________ 。
(8)写出方程式的系数____NaClO+___NaI=____NaIO3+____NaCl___________
(1)
(2)质量为9.8g的H2SO4物质的量是
(3)1.204×1024个H2的物质的量是
(4)配制溶液时,称量5.85gNaCl固体,配制480mL溶液,则溶液物质的量浓度是
(5)标准状况下16gH2的体积是
(6)100mL0.2mol·L-1的Na2SO4溶液中,取出10mL该溶液,c(Na+)=
 )=
)=(7)
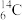 的中子数是
的中子数是(8)写出方程式的系数____NaClO+___NaI=____NaIO3+____NaCl
您最近一年使用:0次
名校
解题方法
4 . 与20mL,含0.01molNaCl的溶液中的Cl- 物质的量浓度相等的是
| A.10mL 0.5mol/L KClO3 溶液 | B.10mL 0.25mol/L CuCl2溶液 |
| C.5mL 0.5 mol/L FeCl3溶液 | D.10mL 0.05 mol/L MgCl2 溶液 |
您最近一年使用:0次
2022-12-18更新
|
154次组卷
|
3卷引用:陕西省西安市西咸新区泾河新城第一中学2023-2024学年高一上学期第二次月考化学试题
名校
解题方法
5 . 将agFe2O3、Al2O3样品溶解在过量的200mL0.1mol/L的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
| A.0.1mol/L | B.0.2mol/L | C.0.4mol/L | D.0.8mol/L |
您最近一年使用:0次
名校
6 . 表示溶液组成的方法有多种:溶质的质量分数、体积比浓度、物质的量浓度等,因此在配制溶液时,根据不同的需要,有不同的配制方法,如:(请完成填空)
I.用10%的氢氧化钠溶液(密度为1.01g/cm3)配制成27.5g2%的氢氧化钠溶液。
(1)需量取_____ mL蒸馏水注入烧杯中,然后再注入_____ g10%氢氧化钠溶液混合均匀。
II.用质量分数为36.5%盐酸(密度为1.16g/cm3)配制1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(2)配制稀盐酸时,应选用容量为___________ mL的容量瓶。
(3)计算已知盐酸的物质的量浓度为___________ 。
(4)经计算需要___________  浓盐酸,在量取时宜选用下列量筒中的
浓盐酸,在量取时宜选用下列量筒中的___________ 。
A.5mL B.10mL C.25mL D.50mL
(5)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入相应规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是___________ (填序号)。
(6)在上述配制过程中,定容时俯视刻度线,其配制的稀盐酸浓度是__________ (填“偏高”、“偏低”或“无影响”);若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是______ (填“偏高”、“偏低”或“无影响”)。
I.用10%的氢氧化钠溶液(密度为1.01g/cm3)配制成27.5g2%的氢氧化钠溶液。
(1)需量取
II.用质量分数为36.5%盐酸(密度为1.16g/cm3)配制1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(2)配制稀盐酸时,应选用容量为
(3)计算已知盐酸的物质的量浓度为
(4)经计算需要
 浓盐酸,在量取时宜选用下列量筒中的
浓盐酸,在量取时宜选用下列量筒中的A.5mL B.10mL C.25mL D.50mL
(5)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入相应规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是
(6)在上述配制过程中,定容时俯视刻度线,其配制的稀盐酸浓度是
您最近一年使用:0次
7 . 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示,回答下列有关问题:

(1)根据标签提供的信息,该注射液中葡萄糖的物质的量浓度为_______ 。
(2)1mol葡萄糖完全燃烧(产物为CO2和H2O),可产生H2O的质量为_______ 克。可产生标准状况下CO2的体积为_______ 升(请写出计算过程)。

(1)根据标签提供的信息,该注射液中葡萄糖的物质的量浓度为
(2)1mol葡萄糖完全燃烧(产物为CO2和H2O),可产生H2O的质量为
您最近一年使用:0次
8 . 小铭将wgNaCl晶体完全溶于1L水中,溶解和电离过程如图所示。下列说法正确的是
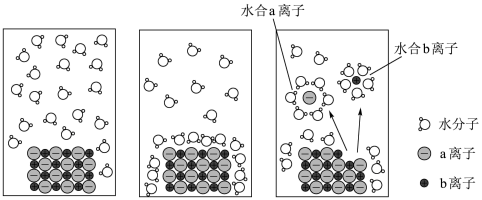

| A.a离子为Cl-,b离子为Na+ |
| B.溶解和电离过程中,水分子与晶体不存在相互作用 |
C.所得溶液中c(Na+)等于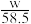 mol/L mol/L |
| D.若向溶液中再加入NaCl固体,离子浓度不再变化时,则所得为饱和溶液 |
您最近一年使用:0次
9 . 现有CO和CO2的混合气体,在标准状况下的体积为11.2L。请回答下列问题:(用NA表示阿伏加德罗常数的值)
(1)该混合气体总的物质的量为_______ 。
(2)混合气体中碳原子的个数为_______ 。
(3)为测定混合气体的组成,将该混合气体全部通过下图装置进行实验。经测定,A瓶中得到白色沉淀19.7g。
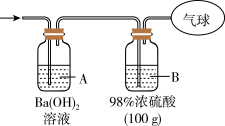
①从A瓶中获得沉淀的化学反应方程式_______ 。
②Ba(OH)2溶液浓度的测定。步骤如下:
a.过滤A溶液,得到滤液100mL(忽略溶液体积的微小变化)
b.将B瓶中的溶液配成1L溶液
c.将B瓶配制的溶液慢慢加入100mL滤液中直到不再产生沉淀。共消耗配制液50mL。
则步骤c中得到的沉淀的物质的量为_______ 。原Ba(OH)2溶液的浓度为_______ 。
③气球中收集到的气体的质量为_______ 。
(1)该混合气体总的物质的量为
(2)混合气体中碳原子的个数为
(3)为测定混合气体的组成,将该混合气体全部通过下图装置进行实验。经测定,A瓶中得到白色沉淀19.7g。

①从A瓶中获得沉淀的化学反应方程式
②Ba(OH)2溶液浓度的测定。步骤如下:
a.过滤A溶液,得到滤液100mL(忽略溶液体积的微小变化)
b.将B瓶中的溶液配成1L溶液
c.将B瓶配制的溶液慢慢加入100mL滤液中直到不再产生沉淀。共消耗配制液50mL。
则步骤c中得到的沉淀的物质的量为
③气球中收集到的气体的质量为
您最近一年使用:0次
2022-12-12更新
|
295次组卷
|
2卷引用:陕西省西安市第八十三中学2022-2023学年高一上学期第二次月考化学试题
解题方法
10 . 下到溶液中的Cl-物质的量浓度与100mL 1moL/L的氯化镁溶液中氯离子物质的量浓度相等的是
| A.150mL 1moL/L的氯化钠溶液 |
| B.100mL 2moL/L的氯化钾溶液 |
| C.75mL 0.5moL/L的氯化钙溶液 |
| D.75mL 1moL/L的氯化铝溶液 |
您最近一年使用:0次



