1 . 氢化铝锂(LiAlH4)是化工生产中广泛应用于药物合成的常用试剂。
(1)LiAlH4可将乙醛转化为乙醇,LiAlH4作该反应的______ 剂(选填“氧化”“还原”“催化”),用____ (填试剂名称)可检验乙醛已完全转化。
(2)配平化学反应方程式。
______ LiAlH4+______ H2SO4→______ Li2SO4+_______ Al2(SO4)3+_______ H2↑
该反应中H2SO4体现________ 性。若上述反应中电子转移数目为0.2NA个,则生成标准状况下氢气体积为_____________ 。
(3)现有两种浓度的LiOH溶液,已知a溶液的pH大于b溶液,则两种溶液中由水电离的c(H+)大小关系是:a_____ b(选填“>”、“<”或“=”)。
(4)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝。
_____________________________
(1)LiAlH4可将乙醛转化为乙醇,LiAlH4作该反应的
(2)配平化学反应方程式。
该反应中H2SO4体现
(3)现有两种浓度的LiOH溶液,已知a溶液的pH大于b溶液,则两种溶液中由水电离的c(H+)大小关系是:a
(4)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝。
您最近一年使用:0次
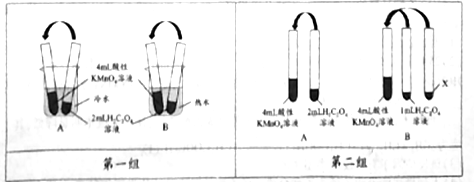
2 . 完成下列有关KMnO4溶液和H2C2O4溶液的实验:
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用_____ 进行酸化,参加反应的物质n(KMnO4):n(H2C2O4)=_____ .
(2)第一组实验中褪色时间更长的是:_____ (填“A”或“B”)组实验。
(3)第二组实验中B组实验中X为:__________ 。
(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为_________ 。
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入_____ (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,需将锥形瓶摇动一段时间后,紫红色才慢慢褪去,再继续滴加时,紫红色就很快褪去了。出现上述现象的原因是_______ 。待到______ ,证明达到滴定终点。
(6)计算:再重复上述操作3次,记录数据如下表:
则x为__________ 。
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是_______ (填序号)
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用
(2)第一组实验中褪色时间更长的是:
(3)第二组实验中B组实验中X为:

(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入
(6)计算:再重复上述操作3次,记录数据如下表:
实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.20 | 20.20 |
4 | 0.00 | 22.10 |
则x为
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
解题方法
3 . 用NA表示阿伏加德罗常数,判断下列说法是否正确。
1.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA。(_______)
2.常温下,密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA。(_______)
3.常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子。(_______)
4.一定条件下,用 1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA。(_______)
5.标准状况下,将22.4 L Cl2通入足量水中充分反应,转移电子数小于NA。(_______)
1.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA。(_______)
2.常温下,密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA。(_______)
3.常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子。(_______)
4.一定条件下,用 1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA。(_______)
5.标准状况下,将22.4 L Cl2通入足量水中充分反应,转移电子数小于NA。(_______)
您最近一年使用:0次
4 . 用NA表示阿伏加德罗常数,判断下列说法是否正确。
1.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA。(_______)
2.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2NA。(_______)
3.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA。(_______)
4.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA。(_______)
5.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子的数目不小于3NA。(_______)
6.1 mol Cl2参加反应转移电子数一定为2NA。(_______)
7.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数小于2NA。(_______)
8.0.3 mol NO2与足量的水反应转移电子数目为0.2NA。(_______)
1.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA。(_______)
2.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2NA。(_______)
3.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA。(_______)
4.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA。(_______)
5.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子的数目不小于3NA。(_______)
6.1 mol Cl2参加反应转移电子数一定为2NA。(_______)
7.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数小于2NA。(_______)
8.0.3 mol NO2与足量的水反应转移电子数目为0.2NA。(_______)
您最近一年使用:0次
名校
5 . 纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,其水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:_____ 。
(2)实验室中用过氧化氢制取氧气的化学方程式为____ ,当生成标准状况下1.12 L O2时,转移电子为___ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:___________ 。
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量。
①写出该反应的离子方程式____________ 。
②滴定到达终点的现象是____________ 。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
则试样中过氧化氢的浓度为____ mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果____ (填“偏低”、“偏高”或“不变”)。
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确___________ 。
(1)写出过氧化氢的电子式:
(2)实验室中用过氧化氢制取氧气的化学方程式为
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量。
①写出该反应的离子方程式
②滴定到达终点的现象是
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 19.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确
您最近一年使用:0次



