名校
1 . 二氧化氯在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯化物。制备ClO2的方法是:
_____NaClO3+_______HCl=______ClO2↑+______Cl2↑+______NaCl+_______H2O
(1)试配平上述化学方程式,并用标出电子转移的方向和数目___________ 。
(2)该反应中HCl体现的性质是___________。
(3)在标准状况下,每生成10.08L气体,转移的电子数为___________ 。
(4)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒无害的两种气体,自身被还原为Cl-。处理含CN-相同时的电镀废水,所需Cl2的物质的量是ClO2的___________ 倍。
_____NaClO3+_______HCl=______ClO2↑+______Cl2↑+______NaCl+_______H2O
(1)试配平上述化学方程式,并用标出电子转移的方向和数目
(2)该反应中HCl体现的性质是___________。
| A.氧化性 | B.还原性 | C.酸性 | D.挥发性 |
(4)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒无害的两种气体,自身被还原为Cl-。处理含CN-相同时的电镀废水,所需Cl2的物质的量是ClO2的
您最近一年使用:0次
2 . 实验室可以根据下列方程式制备氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
(1)反应①的离子方程式为(MnCl2为易溶易电离的物质)_________ 。
(2)用双线桥法表示该反应中电子转移的方向和数目_________ 。
(3)浓盐酸在该反应中的作用是(填序号)_________ ①氧化性②还原性③酸性,若在标准状况下,制得氯气的体积为2.24L,则被氧化的氯化氢的物质的量为_________ 。
 MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
MnCl2+Cl2↑+2H2O;根据反应回答下列问题:(1)反应①的离子方程式为(MnCl2为易溶易电离的物质)
(2)用双线桥法表示该反应中电子转移的方向和数目
(3)浓盐酸在该反应中的作用是(填序号)
您最近一年使用:0次
23-24高三上·上海浦东新·阶段练习
名校
解题方法
3 . 业内人士预测,2023年对中国汽车的出口量将历史性的超过日本,成为世界第一、中国电动汽车技术处于世界领先地位。比亚迪公司充电电池全线搭载了刀片电池,刀片电池具有续航里程高,安全性好的优点。刀片电池的正极材料使用了磷酸铁锂(LiFePO4)。磷酸铁锂(LiFePO4)由Li2CO3、C6H12O6和FePO4在高温条件下制备。
(1)LiFePO4中的化合物态的铁价电子排布式为___________ ,铁元素在元素周期表中的位置为___________ 。
(2)C6H12O6在反应中表现出___________ (填氧化性、还原性),每生成27 g C6H12O6参与反应,转移电子数目为___________ 。
(3)CO2的电子式为___________ ,Li2CO3中负离子的立体结构为___________ 。
(4)电动汽车相对于燃油动力汽车更加环保,原因是___________ 。

(1)LiFePO4中的化合物态的铁价电子排布式为
(2)C6H12O6在反应中表现出
(3)CO2的电子式为
(4)电动汽车相对于燃油动力汽车更加环保,原因是
您最近一年使用:0次
名校
4 . 纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,其水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:_____ 。
(2)实验室中用过氧化氢制取氧气的化学方程式为____ ,当生成标准状况下1.12 L O2时,转移电子为___ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:___________ 。
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量。
①写出该反应的离子方程式____________ 。
②滴定到达终点的现象是____________ 。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
则试样中过氧化氢的浓度为____ mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果____ (填“偏低”、“偏高”或“不变”)。
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确___________ 。
(1)写出过氧化氢的电子式:
(2)实验室中用过氧化氢制取氧气的化学方程式为
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量。
①写出该反应的离子方程式
②滴定到达终点的现象是
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 19.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确
您最近一年使用:0次
名校
5 . 用电弧法合成碳纳米管,常伴有大量杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑。
(1)用双线桥法表示出电子转移方向和数目___________ 。
(2)此反应的氧化产物和还原产物的物质的量之比为___________ 。
(3)要使10mL1.0mol·L-1K2Cr2O7溶液被还原,至少要加入___________ mL2.0mol·L-1的H2SO4溶液,消耗C的质量为___________ g。
(4)若产生6.72LCO2(标准状况下)气体,该反应转移电子的物质的量为___________ mol。
(5)H2SO4在上述反应中表现出来的性质是___________。
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑。
(1)用双线桥法表示出电子转移方向和数目
(2)此反应的氧化产物和还原产物的物质的量之比为
(3)要使10mL1.0mol·L-1K2Cr2O7溶液被还原,至少要加入
(4)若产生6.72LCO2(标准状况下)气体,该反应转移电子的物质的量为
(5)H2SO4在上述反应中表现出来的性质是___________。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
您最近一年使用:0次
名校
解题方法
6 . 化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是___________ (填序号)。
a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
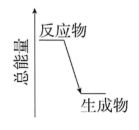
(2)H2O2分解时的能量变化关系如图所示,则H2O2分解反应为___________ 反应 (选填:吸热、放热)。
查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和___________ 。
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:
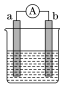
①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为___________ (填名称)。
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为___________ 。
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为___________ 。
(1)下列变化属于放热反应的是
a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
(2)H2O2分解时的能量变化关系如图所示,则H2O2分解反应为

查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:

①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为
您最近一年使用:0次
2021-05-11更新
|
270次组卷
|
2卷引用:山东省济宁市任城区2020-2021学年高一下学期期中考试化学试题
名校
7 . Ⅰ.钛及其合金具有密度小,强度高,耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油化工、医药等部门,因此,钛被誉为第三金属和战略金属。从钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:
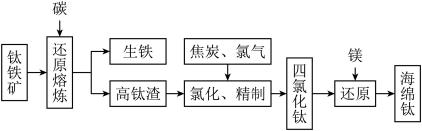
(1)钛铁矿的主要成分是 ,第一步发生的反应:
,第一步发生的反应: ,在钛酸亚铁中,钛的化合价为
,在钛酸亚铁中,钛的化合价为___________ 。
(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,该反应的氧化产物是___________ ,氧化剂和还原剂的化学计量数之比是___________ 。
Ⅱ.高铁酸钾 是一种新型、高效、多功能绿色水处理剂,比
是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入 至饱和,使高铁酸钾析出。
至饱和,使高铁酸钾析出。
(3)干法制备高铁酸钠的主要反应为: 该反应中还原剂是
该反应中还原剂是___________ (填化学式)。
(4)湿法制备高铁酸钾( )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。
。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:___________ 。
②每生成 转移
转移___________  电子,若反应过程中转移了
电子,若反应过程中转移了 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为___________ mol。

(1)钛铁矿的主要成分是
 ,第一步发生的反应:
,第一步发生的反应: ,在钛酸亚铁中,钛的化合价为
,在钛酸亚铁中,钛的化合价为(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,该反应的氧化产物是
Ⅱ.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂,比
是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入 至饱和,使高铁酸钾析出。
至饱和,使高铁酸钾析出。(3)干法制备高铁酸钠的主要反应为:
 该反应中还原剂是
该反应中还原剂是(4)湿法制备高铁酸钾(
 )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。
。①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
②每生成
 转移
转移 电子,若反应过程中转移了
电子,若反应过程中转移了 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为
您最近一年使用:0次
2023-07-17更新
|
333次组卷
|
3卷引用:安徽省阜阳市阜南县2022-2023学年高一上学期期末联考化学试题
名校
解题方法
8 . H2O2作为一种绿色消毒剂,在公共卫生事业中发挥了重要的作用。回答问题:
(1)H2O2中氧元素的化合价为________ 价。
(2)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是______ 。
(3)纯H2O2 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2 剧烈分解:2H2O2 2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2
2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2_____ L,转移电子______ mol。
(4)漂白粉也具有杀菌、消毒的作用,漂白粉的有效成分是_________ 。
(1)H2O2中氧元素的化合价为
(2)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(3)纯H2O2 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2 剧烈分解:2H2O2
 2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2
2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2(4)漂白粉也具有杀菌、消毒的作用,漂白粉的有效成分是
您最近一年使用:0次
9 . 氯元素是中学化学中常见的重要非金属元素之一,氯元素的单质及其化合物在生产与生活中有着重要的用途,依据所学知识完成下列问题:
Ⅰ.实验室制备氯气的化学方程式是_____________________ ;多余的氯气用氢氧化钠溶液吸收,其离子方程式为_________________
Ⅱ.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,还有 NaCl与C12生成。
(1)写出并配平该反应的化学方程式____________________ 。
(2)如果反应中生成标准状况下11.2L 氯气,则被氧化的 HCl的物质的量为_______ ,转移电子数为_________ 。
(3)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式____________ 。
Ⅰ.实验室制备氯气的化学方程式是
Ⅱ.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,还有 NaCl与C12生成。
(1)写出并配平该反应的化学方程式
(2)如果反应中生成标准状况下11.2L 氯气,则被氧化的 HCl的物质的量为
(3)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式
您最近一年使用:0次
名校
10 . (1)写出离子方程式:向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+刚好沉淀完全________ ;
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为________ mol/L
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是__________ ;
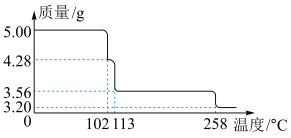
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为______________ ;
(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式_____
(2)标况下,将224L氯化氢气体溶于V升水中,所得溶液密度为dg/mL,则此溶液中溶质的物质的量浓度为
(3)使物质的量浓度之比为1:2:3的氯化钠、氯化镁、氯化铝溶液中的Cl-恰好完全沉淀时,若所用相同物质的量浓度的硝酸银溶液的体积比为3:2:3,则上述三种溶液的体积之比是
(4)5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则200℃时所得固体物质的化学式为

(5)已知氧化性:Cl2>Fe3+>I2,写出FeI2和Cl2按物质的量之比为7:8反应的总离子方程式
您最近一年使用:0次



