解题方法
1 . 维生素C又称“抗坏血酸”,在生物体内维生素C是一种抗氧化剂,因为它能够保护身体免于氧化剂的威胁,维生素C同时也是一种辅酶, 能增强人体对疾病的抵抗能力。
(1)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈______ 性。
A、酸性 B、碱性 C、氧化性 D、还原性
(2)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。这说明铁离子具有___________ 性,上述反应中维生素C是___________ 剂。
(3)写出下列反应的离子反应方程式
①用小苏打片(NaHCO3)治疗胃酸(盐酸)过多的离子方程式为___________
②如果病人同时患有胃溃疡,此时最好服用胃舒平{主要成分是Al(OH)3},反应的离子方程式为___________
(4)写出符合下列离子反应的化学方程式
①Ca2++CO =CaCO3↓
=CaCO3↓___________
②Cu+2Ag+=Cu2++2Ag___________
(1)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈
A、酸性 B、碱性 C、氧化性 D、还原性
(2)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。这说明铁离子具有
(3)写出下列反应的离子反应方程式
①用小苏打片(NaHCO3)治疗胃酸(盐酸)过多的离子方程式为
②如果病人同时患有胃溃疡,此时最好服用胃舒平{主要成分是Al(OH)3},反应的离子方程式为
(4)写出符合下列离子反应的化学方程式
①Ca2++CO
 =CaCO3↓
=CaCO3↓②Cu+2Ag+=Cu2++2Ag
您最近一年使用:0次
解题方法
2 . 维生素C又称“抗坏血酸”,在生物体内维生素C是一种抗氧化剂,因为它能够保护身体免于氧化剂的威胁,维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(1)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈__ 性。
A.酸性 B.碱性 C.氧化性 D.还原性
(2)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。这说明铁离子具有__ 性,上述反应中维生素C是__ 剂。
(3)写出下列反应的离子反应方程式。
①用小苏打片(NaHCO3)治疗胃酸(盐酸)过多的离子方程式为__ 。
②如果病人同时患有胃溃疡,此时最好服用胃舒平{主要成分是Al(OH)3},反应的离子方程式为___ 。
(4)写出符合下列离子反应的化学方程式
①Ca2++CO =CaCO3↓
=CaCO3↓___ 。
②Cu2++Fe=Cu+Fe2+___ 。
(5)给下列方程式配平并用双线桥标电子转移方向和数目:__ MnO2+__ HCl(浓)=__ MnCl2+__ Cl2↑+__ H2O__
(1)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈
A.酸性 B.碱性 C.氧化性 D.还原性
(2)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。这说明铁离子具有
(3)写出下列反应的离子反应方程式。
①用小苏打片(NaHCO3)治疗胃酸(盐酸)过多的离子方程式为
②如果病人同时患有胃溃疡,此时最好服用胃舒平{主要成分是Al(OH)3},反应的离子方程式为
(4)写出符合下列离子反应的化学方程式
①Ca2++CO
 =CaCO3↓
=CaCO3↓②Cu2++Fe=Cu+Fe2+
(5)给下列方程式配平并用双线桥标电子转移方向和数目:
您最近一年使用:0次
名校
3 . 离子反应与氧化还原反应在生活生产中用途广泛,请按要求完成方程式并配平。
(1)过氧化钠与二氧化碳反应的化学方程式__________________________ 。
(2)烧碱与小苏打溶液反应的化学方程式__________________ 。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式___________ ;如果病人同时患胃溃疡,为防止胃壁穿孔,此时其实最好服用含氢氧化铝的胃药(如胃舒平),写出该反应的离子方程式________________ 。
(4)离子的共存与溶液酸碱性密切相关。如S2-和SO32-在碱性条件下可以共存,但在酸性条件下,因反应生成淡黄色单质沉淀而不能大量共存。请写出S2-和SO32-在酸性环境中发生反应的离子方程式_____________________ 。
(5)高铁酸钠(Na2FeO4)有强氧化性,可以有效杀灭水中的细菌和病毒。已知湿法制备高铁酸钠的反应体系有六种微粒:Fe(OH)3、ClO-、H2O 、OH-、FeO42-、Cl-。写出制备高铁酸钠的离子方程式__________________________ 。
(1)过氧化钠与二氧化碳反应的化学方程式
(2)烧碱与小苏打溶液反应的化学方程式
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式
(4)离子的共存与溶液酸碱性密切相关。如S2-和SO32-在碱性条件下可以共存,但在酸性条件下,因反应生成淡黄色单质沉淀而不能大量共存。请写出S2-和SO32-在酸性环境中发生反应的离子方程式
(5)高铁酸钠(Na2FeO4)有强氧化性,可以有效杀灭水中的细菌和病毒。已知湿法制备高铁酸钠的反应体系有六种微粒:Fe(OH)3、ClO-、H2O 、OH-、FeO42-、Cl-。写出制备高铁酸钠的离子方程式
您最近一年使用:0次
2019-12-16更新
|
95次组卷
|
2卷引用:山西省长治市第二中学2019-2020学年高一上学期12月月考化学试题
名校
4 . Ⅰ.电解质溶液导电的能力的强弱主要由自由移动的离子的浓度的大小决定,离子浓度越大,导电能力越强,向一定体积的稀硫酸中逐滴加入氢氧化钡溶液,反应混合液的导电能力随时间变化的曲线如图所示。

(1)ac段发生的反应的离子方程式为:_________ 。
(2)下列说法正确的是_________。
Ⅱ. 是国际公认的高效安全杀菌消毒剂,工业制备
是国际公认的高效安全杀菌消毒剂,工业制备 的反应原理如下:
的反应原理如下:
(3)该反应中,氧化产物是_________ (填化学式),还原剂是_________ (填化学式),依据氧化还原反应规律判断,氧化性强弱为
_________  (填>、<或=)。
(填>、<或=)。
(4)亚氯酸钠 是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:

请将流程中反应①的离子方程式中所缺的物质补充完整并配平:_________ 。

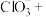

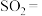


 _________
_________

(1)ac段发生的反应的离子方程式为:
(2)下列说法正确的是_________。
| A.b处溶液呈碱性,d处溶液呈酸性 |
B.c处主要成分是 和 和 |
| C.c时刻溶液的导电能力约为零,说明溶液中几乎没有自由移动的离子 |
| D.ce段溶液的导电能力不断增大,主要是由于过量的氢氧化钡电离出的离子导电 |
Ⅱ.
 是国际公认的高效安全杀菌消毒剂,工业制备
是国际公认的高效安全杀菌消毒剂,工业制备 的反应原理如下:
的反应原理如下:
(3)该反应中,氧化产物是

 (填>、<或=)。
(填>、<或=)。(4)亚氯酸钠
 是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
请将流程中反应①的离子方程式中所缺的物质补充完整并配平:

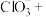

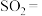


 _________
_________
您最近一年使用:0次
名校
解题方法
5 . (1)难溶物PbSO4溶于CH3COONH4溶液可制得易溶于水的(CH3COO)2Pb,发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是________ (填“强”或“弱”)电解质。
(2)已知次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成NaH2PO2和H2O,则次磷酸是_____ 元酸(填“一”、“二”或“三”)。
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式,并用双线桥法标出电子转移方向及数目______ 。
____Fe(OH)3+____ClO-+____OH-=__FeO +___Cl-+______
+___Cl-+______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________ ;当有2mol H3PO4生成,转移的电子数目为____ e-
(2)已知次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成NaH2PO2和H2O,则次磷酸是
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式,并用双线桥法标出电子转移方向及数目
____Fe(OH)3+____ClO-+____OH-=__FeO
 +___Cl-+______
+___Cl-+______(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是
您最近一年使用:0次
名校
6 . 请按要求书写下列离子方程式:
(1)复分解离子反应中,量变引起的变化
①将NaHSO4溶液滴加到Ba(OH)2溶液中,当溶液恰好呈中性时,反应的离子方程式为___________ 。
②向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式___________ 。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为___________ 。
③0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:____________ 。
(2)氧化还原反应中,反应物及量的变化。向含有a mol FeBr2的溶液中,通入x mol Cl2,若x=a_____________ ,若x=4a_______________________________ ;
(3)特殊条件下离子反应方程式的书写
①在碱性条件下,Cl2可将废水中的CN—氧化为无毒的CO2、N2,该过程的离子反应方程式为__________ 。
②在酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+,该过程的离子反应方程式为_______ 。
③在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为________ 。
(1)复分解离子反应中,量变引起的变化
①将NaHSO4溶液滴加到Ba(OH)2溶液中,当溶液恰好呈中性时,反应的离子方程式为
②向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式
③0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
(2)氧化还原反应中,反应物及量的变化。向含有a mol FeBr2的溶液中,通入x mol Cl2,若x=a
(3)特殊条件下离子反应方程式的书写
①在碱性条件下,Cl2可将废水中的CN—氧化为无毒的CO2、N2,该过程的离子反应方程式为
②在酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+,该过程的离子反应方程式为
③在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为
您最近一年使用:0次
2017-11-02更新
|
1729次组卷
|
8卷引用:天津市静海县第一中学2018届高三9月学生学业能力调研考试化学试题
天津市静海县第一中学2018届高三9月学生学业能力调研考试化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期末考试化学试题(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 讲(已下线)考点04 离子反应——《备战2020年高考精选考点专项突破题集》(已下线)第06讲 离子反应 离子方程式(精练)——2021年高考化学一轮复习讲练测(已下线)第3单元 离子反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第04讲 离子反应 离子方程式(精练)-2022年高考化学一轮复习讲练测(已下线)微专题05 破解与量有关离子方程式书写的四型和四法-备战2022年高考化学考点微专题
名校
解题方法
7 . 化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的基础自然科学。
(1)根据下列物质的组成和性质完成填空。
a.铁 b.硫酸铜溶液 c.熔融氯化钠 d.过氧化钠固体 e.石墨 f.氨气
①属于电解质的是___________ (填字母序号,下同)。
②上述状态下能导电的物质有___________ 。
③写出硫酸铜的电离方程式___________ 。
(2)向一定量的 和
和 混合溶液中逐滴滴加氢氧化钠溶液至过量(体积变化忽略不计)。下列图像不能正确反映对应变化关系的是___________。
混合溶液中逐滴滴加氢氧化钠溶液至过量(体积变化忽略不计)。下列图像不能正确反映对应变化关系的是___________。
(3)经检测,某酸性废水中存在大量的 、
、 、
、 、
、 。现进行以下实验:
。现进行以下实验:
①取100 mL该废水于烧杯中,逐滴滴加NaOH溶液至呈碱性,原废水中离子的数目会发生变化的是___________ (用离子符号表示)。
②欲除去其中的 、
、 ,并得到中性溶液,设计的工艺流程如图所示。
,并得到中性溶液,设计的工艺流程如图所示。

操作X的名称是___________ ,试剂b中溶质的化学式为___________ 。
③测得100 mL废水中 、
、 、
、 、
、 的物质的量浓度分别为0.5 mol/L、0.5 mol/L、0.1 mol/L、0.2 mol/L,则该废水中
的物质的量浓度分别为0.5 mol/L、0.5 mol/L、0.1 mol/L、0.2 mol/L,则该废水中
___________ 。
(1)根据下列物质的组成和性质完成填空。
a.铁 b.硫酸铜溶液 c.熔融氯化钠 d.过氧化钠固体 e.石墨 f.氨气
①属于电解质的是
②上述状态下能导电的物质有
③写出硫酸铜的电离方程式
(2)向一定量的
 和
和 混合溶液中逐滴滴加氢氧化钠溶液至过量(体积变化忽略不计)。下列图像不能正确反映对应变化关系的是___________。
混合溶液中逐滴滴加氢氧化钠溶液至过量(体积变化忽略不计)。下列图像不能正确反映对应变化关系的是___________。A.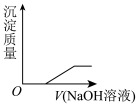 | B.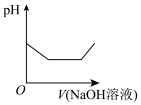 |
C.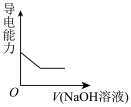 | D. |
(3)经检测,某酸性废水中存在大量的
 、
、 、
、 、
、 。现进行以下实验:
。现进行以下实验:①取100 mL该废水于烧杯中,逐滴滴加NaOH溶液至呈碱性,原废水中离子的数目会发生变化的是
②欲除去其中的
 、
、 ,并得到中性溶液,设计的工艺流程如图所示。
,并得到中性溶液,设计的工艺流程如图所示。
操作X的名称是
③测得100 mL废水中
 、
、 、
、 、
、 的物质的量浓度分别为0.5 mol/L、0.5 mol/L、0.1 mol/L、0.2 mol/L,则该废水中
的物质的量浓度分别为0.5 mol/L、0.5 mol/L、0.1 mol/L、0.2 mol/L,则该废水中
您最近一年使用:0次
名校
8 . 写出下列反应的离子方程式:
(1)向AlCl3溶液中加入过量NaOH溶液:_______
(2)向FeI2溶液中通入完全过量的氯气:_______
(3)向1L1mol/L的NH4Al(SO4)2溶液中滴加2L等浓度的Ba(OH)2溶液:_______
(4) 与
与 水溶液混合后恰好沉淀完全的离子方程式
水溶液混合后恰好沉淀完全的离子方程式_______
(5)用ClO2进行饮用水处理比使用Cl2具有更高的优越性,不仅杀菌消毒效率高,不产生致癌的有机氯代物,而且还能除去水中的Fe2+,Mn2+。请写出用ClO2除去饮用水中Mn2+的离子方程式:_______ (已知Mn2+转变为MnO2,ClO2转变为 )
)
(6)Fe的一种含氧酸根离子 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式为:
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式为:_______
(1)向AlCl3溶液中加入过量NaOH溶液:
(2)向FeI2溶液中通入完全过量的氯气:
(3)向1L1mol/L的NH4Al(SO4)2溶液中滴加2L等浓度的Ba(OH)2溶液:
(4)
 与
与 水溶液混合后恰好沉淀完全的离子方程式
水溶液混合后恰好沉淀完全的离子方程式(5)用ClO2进行饮用水处理比使用Cl2具有更高的优越性,不仅杀菌消毒效率高,不产生致癌的有机氯代物,而且还能除去水中的Fe2+,Mn2+。请写出用ClO2除去饮用水中Mn2+的离子方程式:
 )
)(6)Fe的一种含氧酸根离子
 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式为:
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式为:
您最近一年使用:0次
2021-09-01更新
|
322次组卷
|
2卷引用:甘肃省天水市一中2022届高三上学期8月第一次考试化学试题
名校
9 . (1)将铝片投入氢氧化钠溶液的离子反应方程式为:_____ 。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2L 等浓度的Ba(OH)2溶液,离子反应方程式为:__ 。
(3)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为___ 。
(4)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为____ 。
(5)Fe的一种含氧酸根 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是______ 。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2L 等浓度的Ba(OH)2溶液,离子反应方程式为:
(3)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为
(4)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
(5)Fe的一种含氧酸根
 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
您最近一年使用:0次
2020-10-30更新
|
244次组卷
|
2卷引用:辽宁省实验中学东戴河校区2021届高三上学期第一次月考化学试题
名校
解题方法
10 . (1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:_____ ,若是改加氢氧化钡溶液至中性,离子反应方程式为:______ 。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2.25L 等浓度的Ba(OH)2溶液,离子反应方程式为:__ 。
(3)向含FeI2和FeBr2各1mol 的混合液中通入氯气2.5 mol,离子反应方程式为:____ 。
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为___ 。
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为____ 。
(6) Fe的一种含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是______ 。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2.25L 等浓度的Ba(OH)2溶液,离子反应方程式为:
(3)向含FeI2和FeBr2各1mol 的混合液中通入氯气2.5 mol,离子反应方程式为:
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
(6) Fe的一种含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
您最近一年使用:0次



