1 . 金属钠及其化合物在人类生产、生活中起着重要作用。诸回答下列问题:
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为___________ ,采用空气和Na为原料可直接制备Na2O2.空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)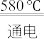 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
①配平上述离子方程式___________ 。
②该反应说明Na2O2具有___________ (选填“氧化性”“还原性"或“漂白性”)。
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为___________ 。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
A.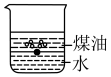 | B.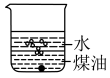 |
C. | D. |
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)
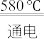 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O①配平上述离子方程式
②该反应说明Na2O2具有
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为
您最近一年使用:0次
名校
解题方法
2 . 某同学在实验室欲配制物质的量浓度均为1.0mol·L-1的NaOH溶液、稀硫酸各450mL。提供的试剂是:NaOH固体、18.4mol·L-1的浓硫酸(密度为1.84g·cm-3)和蒸馏水。
(1)请你观察图示判断其中不正确的操作有_______ 。(填序号)
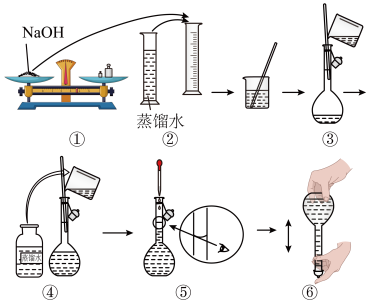
(2)应用托盘天平称量NaOH_______ g,应用量筒量取浓硫酸_______ mL。
(3)在配制上述溶液实验中,下列操作引起结果偏低的有_______ 。
A.该学生在量取浓硫酸时,仰视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗涤液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度线
(4)若用0.01000mol·L-1K2Cr2O7(酸性)溶液滴定20.00mL未知浓度的含Fe2+的溶液,恰好完全反应时消10.00mLK2Cr2O7溶液,写出该反应的离子反应方程式_______ ,待测液中Fe2+的浓度是_______ g/L(保留4位有效数字)。
(1)请你观察图示判断其中不正确的操作有

(2)应用托盘天平称量NaOH
(3)在配制上述溶液实验中,下列操作引起结果偏低的有
A.该学生在量取浓硫酸时,仰视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗涤液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度线
(4)若用0.01000mol·L-1K2Cr2O7(酸性)溶液滴定20.00mL未知浓度的含Fe2+的溶液,恰好完全反应时消10.00mLK2Cr2O7溶液,写出该反应的离子反应方程式
您最近一年使用:0次
2022-08-30更新
|
324次组卷
|
2卷引用:宁夏回族自治区银川一中2022-2023学年高三上学期第一次月考理科综合化学试题



