解题方法
1 . 用盐酸洗钢材会产生“酸洗废液”(主要成分为FeCl2)。工业上用“酸洗废液”经高温氧化制取高纯氧化铁,同时产生的氯化氢气体可回收使用,发生的反应为aFeCl2 +bO2 + cH2O dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是
 dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是| A.a+b+d=7 |
| B.该反应中,每消耗3.2gO2,同时生成32 g Fe2O3 |
| C.该反应中,HCl既是氧化产物也是还原产物 |
| D.将生成的气体通入碳酸氢钙溶液中,会有碳酸钙沉淀生成 |
您最近半年使用:0次
解题方法
2 . 氮及其化合物在生产、生活中广泛应用。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是__________ (写化学式)。写出一个能够生成B的化学方程式__________ 。
(2)实验室中,检验溶液中是否含有 的操作方法是
的操作方法是__________ 。
(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式__________ 。
Ⅱ.下图为实验室模拟尿素法制备水合肼(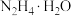 )的流程图:
)的流程图:
已知:①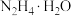 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成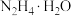 。
。
回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为__________ 。
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为__________ 。
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是__________ 。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是
(2)实验室中,检验溶液中是否含有
 的操作方法是
的操作方法是(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式
Ⅱ.下图为实验室模拟尿素法制备水合肼(
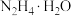 )的流程图:
)的流程图:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。②一定条件下,碱性NaClO溶液与尿素溶液反应生成
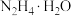 。
。回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是
您最近半年使用:0次
解题方法
3 . 在酸性条件下,黄铁矿( ,其中S为~1价)催化氧化的反应转化如图所示。
,其中S为~1价)催化氧化的反应转化如图所示。
总反应:
(1)分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:_______ 。
②反应Ⅱ:_______ 。
(2)NO在总反应中的作用是_______ 。
 ,其中S为~1价)催化氧化的反应转化如图所示。
,其中S为~1价)催化氧化的反应转化如图所示。
总反应:

(1)分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:
②反应Ⅱ:
(2)NO在总反应中的作用是
您最近半年使用:0次
名校
4 . 高铁酸钾是一种新型水处理剂,使用说明书如下。
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 。
(2)制备 需要在
需要在___________ (填“酸性”“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,错误的是
的说法中,错误的是___________ (填字母)。
a.是具有强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4) 与水反应生成
与水反应生成 胶体、
胶体、 和
和 反应的化学方程式为
反应的化学方程式为___________ ;该反应消耗 转移的电子数为
转移的电子数为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(5)消毒净化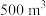 水,至少需要
水,至少需要 的质量为
的质量为___________ 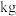 。
。
(6)产生 胶体时,该分散系区别于其他分散系的本质特征是
胶体时,该分散系区别于其他分散系的本质特征是___________ 。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着  减小,稳定性下降。 减小,稳定性下降。 能与水反应放出氧气并通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 能与水反应放出氧气并通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。 胶体,可除去水中细微的悬浮物,有净水作用。【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放 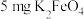 即可达到卫生标准 即可达到卫生标准 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,错误的是
的说法中,错误的是a.是具有强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)
 与水反应生成
与水反应生成 胶体、
胶体、 和
和 反应的化学方程式为
反应的化学方程式为 转移的电子数为
转移的电子数为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(5)消毒净化
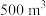 水,至少需要
水,至少需要 的质量为
的质量为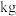 。
。(6)产生
 胶体时,该分散系区别于其他分散系的本质特征是
胶体时,该分散系区别于其他分散系的本质特征是
您最近半年使用:0次
5 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)工业盐的主要成分是 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ (填“氧化”或“还原”,下同)。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________ 性。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。
①配平上述氧化还原反应方程式___________ 。
②该反应中,氧化剂是___________ (填化学式),被氧化的元素是___________ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为:
的反应为: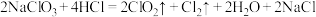 。
。
①该反应中的还原产物是___________ (写化学式),反应中每生成1mol 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为___________ ,转移电子的数目为___________ 。
②用“单线桥”标出反应中电子转移的方向与数目___________ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是___________ (填字母)。
a. b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为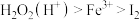 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为___________ 。
(1)工业盐的主要成分是
 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。①配平上述氧化还原反应方程式
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为:
的反应为: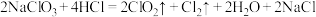 。
。①该反应中的还原产物是
 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为②用“单线桥”标出反应中电子转移的方向与数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是a.
 b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为
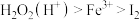 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近半年使用:0次
解题方法
6 . 天然气是一种应用广泛的燃料,含有少量 气体。在酸性溶液中,通过甲、乙两个过程实现天然气的脱硫,原理如图所示。下列说法正确的是
气体。在酸性溶液中,通过甲、乙两个过程实现天然气的脱硫,原理如图所示。下列说法正确的是

 气体。在酸性溶液中,通过甲、乙两个过程实现天然气的脱硫,原理如图所示。下列说法正确的是
气体。在酸性溶液中,通过甲、乙两个过程实现天然气的脱硫,原理如图所示。下列说法正确的是
A.过程甲发生的离子反应为 |
B.过程乙中每 参加反应,需消耗 参加反应,需消耗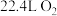 (标准状况) (标准状况) |
C.通过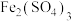 和 和 的相互转化,天然气中的 的相互转化,天然气中的 间接被 间接被 氧化 氧化 |
| D.天然气脱硫一段时间后,溶液酸性增强 |
您最近半年使用:0次
名校
7 . 滴定是一种重要的定量实验方法。现拟用KMnO4溶液去测定市场上售卖的草酸的纯度,步骤如下:(已知:M(H2C2O4)=90g·mol-1)
①称取1.260g草酸样品,将其制成100mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05000mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式___________ 。
(2)滴定时盛装KMnO4标准溶液所用仪器为___________ 。
(3)由如图可知消耗KMnO4溶液体积为___________ mL。

(4)滴定终点的现象为___________ 。
(5)通过上述数据,求得草酸的纯度为___________ 。(精确度保留到0.1)
(6)误差分析:
①以标准KMnO4溶液滴定样品溶液的浓度时,未用标准KMnO4溶液润洗滴定管,引起实验结果___________ (偏大、偏小或无影响,下同);
②用酸式滴定管量取待测液时,未用待测液润洗滴定管,引起实验结果___________ ;
③滴定前有气泡,滴定后气泡消失,引起实验结果___________ ;
④滴定前正确读数,滴定后俯视,引起实验结果___________ 。
①称取1.260g草酸样品,将其制成100mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05000mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式
(2)滴定时盛装KMnO4标准溶液所用仪器为
(3)由如图可知消耗KMnO4溶液体积为

(4)滴定终点的现象为
(5)通过上述数据,求得草酸的纯度为
(6)误差分析:
①以标准KMnO4溶液滴定样品溶液的浓度时,未用标准KMnO4溶液润洗滴定管,引起实验结果
②用酸式滴定管量取待测液时,未用待测液润洗滴定管,引起实验结果
③滴定前有气泡,滴定后气泡消失,引起实验结果
④滴定前正确读数,滴定后俯视,引起实验结果
您最近半年使用:0次
名校
8 . 工业上常常使用过氧化氢,它是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用于消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
(1)移取10.00 mL密度为ρ g·mL-1的过氧化氢溶液至250 mL___________ (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。_______
 MnO
MnO +
+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ H2O+
H2O+ ___________
___________
(3)滴定时,将高锰酸钾标准溶液注入___________ (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________ 。
(4)重复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________ 。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果___________ (填“偏高”或“偏低”)。
(1)移取10.00 mL密度为ρ g·mL-1的过氧化氢溶液至250 mL
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
 MnO
MnO +
+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ H2O+
H2O+ ___________
___________(3)滴定时,将高锰酸钾标准溶液注入
(4)重复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
您最近半年使用:0次
9 . 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可以减少该有害物质向环境排放。例如:
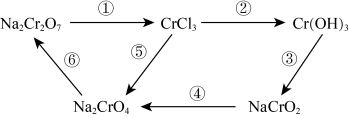
(1)Na2Cr2O7中Cr元素的化合价是______ ,该物质属于_____ (填序号)。
①酸 ②碱 ③盐 ④氧化物
(2)在上述转化中,Cr元素化合价不变的步骤是______ (填序号)。
(3)反应①为: (未配平)。其中还原产物为
(未配平)。其中还原产物为______ ,Na2Cr2O7与Cl2的化学计量数比为_____ 。
(4)完成反应④的配平,并用单线桥标出电子转移的方向和数目。(系数若为1也请写出)_____
反应④为:

(1)Na2Cr2O7中Cr元素的化合价是
①酸 ②碱 ③盐 ④氧化物
(2)在上述转化中,Cr元素化合价不变的步骤是
(3)反应①为:
 (未配平)。其中还原产物为
(未配平)。其中还原产物为(4)完成反应④的配平,并用单线桥标出电子转移的方向和数目。(系数若为1也请写出)
反应④为:

您最近半年使用:0次
10 . 金属钠及其化合物在人类生产、生活中起着重要作用。诸回答下列问题:
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为___________ ,采用空气和Na为原料可直接制备Na2O2.空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)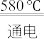 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
①配平上述离子方程式___________ 。
②该反应说明Na2O2具有___________ (选填“氧化性”“还原性"或“漂白性”)。
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为___________ 。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
A.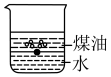 | B.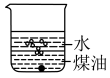 |
C. | D. |
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)
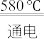 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O①配平上述离子方程式
②该反应说明Na2O2具有
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为
您最近半年使用:0次



