名校
1 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。
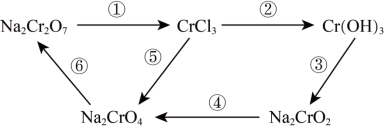
(1)Na2Cr2O7中Cr元素的化合价是______ 。
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生______ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:______ 。
(3)反应④在碱性条件下发生,反应的离子方程式为: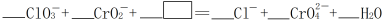 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式______ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生
(3)反应④在碱性条件下发生,反应的离子方程式为:
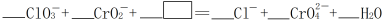 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
步骤一:利用NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐
步骤二:将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
①NaClO2中Cl的化合价为_______ 。
②写出步骤一中生成ClO2的化学方程式_______ 。
③步骤二反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中氧化产物是_______ 。
(2)NaClO2溶液可同时吸收含有SO2、NO的烟气。反应温度为323K,NaClO2溶液浓度为5×10-3mol/L。在碱性环境中,反应一段时间后溶液中离子浓度的分析结果如表。
脱硫过程中SO2主要转化为________ (填离子符号);脱硝过程NO主要转化为_______ (填离子符号),脱硝过程主要反应的离子方程式为_______ 。
(3)NaClO2可以促使氨转化为氮肥,含氮量是衡量肥效的指标之一,常见氮肥:CO(NH2)2(尿素)、NH4NO3和(NH4)2SO4。等物质的量NH4NO3和(NH4)2SO4的混合物,与足量氢氧化钠加热,产生气体10.08L(标准状况下),固体混合物质量为_______ g。
(1)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
步骤一:利用NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐
步骤二:将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
①NaClO2中Cl的化合价为
②写出步骤一中生成ClO2的化学方程式
③步骤二反应中,氧化剂与还原剂的物质的量之比为
(2)NaClO2溶液可同时吸收含有SO2、NO的烟气。反应温度为323K,NaClO2溶液浓度为5×10-3mol/L。在碱性环境中,反应一段时间后溶液中离子浓度的分析结果如表。
| 离子 | SO | SO | NO | NO | Cl- |
| c/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-6 | 3.4×10-3 |
(3)NaClO2可以促使氨转化为氮肥,含氮量是衡量肥效的指标之一,常见氮肥:CO(NH2)2(尿素)、NH4NO3和(NH4)2SO4。等物质的量NH4NO3和(NH4)2SO4的混合物,与足量氢氧化钠加热,产生气体10.08L(标准状况下),固体混合物质量为
您最近一年使用:0次
名校
3 . 填空题
(1)现有以下物质:①Al2(SO4)3晶体,②稀盐酸 ,③冰醋酸(固态纯醋酸) ,④石墨, ⑤酒精(C2H5OH),⑥食盐水,⑦葡萄糖(C6H12O6),请回答下列问题:
Ⅰ.以上物质中属于电解质的是_______ (填序号,下同)。
Ⅱ.以上物质中属于非电解质的是_______ 。
Ⅲ.请写出①在水溶液中的电离方程式_______ 。
(2)配平化学方程式:_______ 。_______Cu + _______HNO3(稀)  _______Cu(NO3)2 + _______NO↑+_______H2O
_______Cu(NO3)2 + _______NO↑+_______H2O
(3)新生成的氢氧化亚铁在空气中会迅速变为灰绿色、最后变为红褐色,其过程中涉及到的化学方程式为:_______ 。
(1)现有以下物质:①Al2(SO4)3晶体,②稀盐酸 ,③冰醋酸(固态纯醋酸) ,④石墨, ⑤酒精(C2H5OH),⑥食盐水,⑦葡萄糖(C6H12O6),请回答下列问题:
Ⅰ.以上物质中属于电解质的是
Ⅱ.以上物质中属于非电解质的是
Ⅲ.请写出①在水溶液中的电离方程式
(2)配平化学方程式:
 _______Cu(NO3)2 + _______NO↑+_______H2O
_______Cu(NO3)2 + _______NO↑+_______H2O(3)新生成的氢氧化亚铁在空气中会迅速变为灰绿色、最后变为红褐色,其过程中涉及到的化学方程式为:
您最近一年使用:0次
2022-12-11更新
|
166次组卷
|
3卷引用:宁夏银川市第三十一中学2021-2022学年高一上学期期末学业检测化学试题
名校
解题方法
4 . 金属钛是一种性能优越的结构材料和功能材料,被誉为“太空金属”。以云南富民钛铁精矿(主要成分为TiO2、FeO、Fe2O3,含SiO2、Al2O3等杂质)为原料,制备海绵状金属钛的流程设计如图:
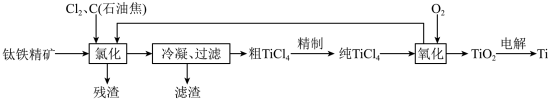
已知:TiCl4及所含杂质氯化物的性质
回答下列问题:
(1)“氯化”过程需在沸腾炉中进行,且需维持在1050℃,若TiO2氯化时生成的CO与CO2的物质的量之比为1:1,则该反应的化学方程式为_______ ;氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_______ (填化学式)。
(2)“精制"过程中,粗TiC4经两步蒸馏得纯TiCl4。第一步蒸馏分离出的杂质是_______ (填化学式);再将温度控制在一定的范围内蒸馏分离出纯TiCl4,所控制温度范围是_______ 。
(3)“氧化”过程的产物中可循环利用的是_______ (填化学式)。

已知:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 |
| 熔点/℃ | -69 | -25 | 193 | 304 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | |
回答下列问题:
(1)“氯化”过程需在沸腾炉中进行,且需维持在1050℃,若TiO2氯化时生成的CO与CO2的物质的量之比为1:1,则该反应的化学方程式为
(2)“精制"过程中,粗TiC4经两步蒸馏得纯TiCl4。第一步蒸馏分离出的杂质是
(3)“氧化”过程的产物中可循环利用的是
您最近一年使用:0次
名校
5 . 高铁酸钾纯品为暗紫色有光泽粉末。在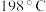 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为 ,工业制备高铁酸钾的离子方程式为
,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是
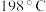 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为 ,工业制备高铁酸钾的离子方程式为
,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是A.由上述反应可知,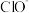 的氧化性强于 的氧化性强于 |
| B.高铁酸钾中铁显+6价 |
C.上述反应氧化剂和还原剂的物质的量之比为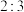 |
D. 处理水时,不仅能消毒杀菌,还生成 处理水时,不仅能消毒杀菌,还生成 水解形成 水解形成 胶体吸附水中悬浮杂质 胶体吸附水中悬浮杂质 |
您最近一年使用:0次
2022-10-30更新
|
217次组卷
|
3卷引用:宁夏银川市第六中学2022-2023学年高三上学期第二次月考化学试题
宁夏银川市第六中学2022-2023学年高三上学期第二次月考化学试题(已下线)专题04 氧化还原反应及其应用(练)-2023年高考化学二轮复习讲练测(新高考专用)广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题
名校
6 . 氧化还原反应在工业生产、环保及科研中有广泛的应用。氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学反应方程式:_______ 。
(2)CuH溶解在稀盐酸中反应的离子化学方程式是_______ 。
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:_______ 。
(1)写出CuH在氯气中燃烧的化学反应方程式:
(2)CuH溶解在稀盐酸中反应的离子化学方程式是
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
您最近一年使用:0次
解题方法
7 . 含氯消毒剂和过氧化物消毒剂均可有效灭杀新冠病毒。
Ⅰ.二氧化氯(ClO2) 是目前国际上公认的第四代高效、无毒的广谱消毒剂。制备ClO2常见的方法有:
方法 1: 2NaClO3+2NaCl+2H2SO4 = 2ClO2↑+Cl2↑+2Na2SO4+2H2O
方法2:在酸性条件下,由NaClO3和双氧水反应制备ClO2。
(1)ClO2中氯元素的化合价是_______ ,H2O2的电子式是_______ 。
(2)方法1的反应中,氧化产物与还原产物的物质的量之比是_______ 。
(3)方法2发生反应的离子方程式是_______ 。
(4)和方法2比较,方法1的不足之处是_______ ( 写出一点即可)。
Ⅱ.过碳酸钠(2Na2CO3·3H2O2),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:2Na2CO3 (aq) +3H2O2 (aq) = 2Na2CO3·3H2O2 (aq) ΔH<0。
(5)已知过氧化氢受热易分解,则碳酸钠与过氧化氢的物质的量之比应_______ (填“>”、“<”或“=”)2: 3,且加入Na2CO3溶液速度不能过快,原因是 _______ 。
Ⅰ.二氧化氯(ClO2) 是目前国际上公认的第四代高效、无毒的广谱消毒剂。制备ClO2常见的方法有:
方法 1: 2NaClO3+2NaCl+2H2SO4 = 2ClO2↑+Cl2↑+2Na2SO4+2H2O
方法2:在酸性条件下,由NaClO3和双氧水反应制备ClO2。
(1)ClO2中氯元素的化合价是
(2)方法1的反应中,氧化产物与还原产物的物质的量之比是
(3)方法2发生反应的离子方程式是
(4)和方法2比较,方法1的不足之处是
Ⅱ.过碳酸钠(2Na2CO3·3H2O2),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:2Na2CO3 (aq) +3H2O2 (aq) = 2Na2CO3·3H2O2 (aq) ΔH<0。
(5)已知过氧化氢受热易分解,则碳酸钠与过氧化氢的物质的量之比应
您最近一年使用:0次
名校
解题方法
8 . 已知Mn2O 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是
 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是| A.+2 | B.+4 | C.+3 | D.+6 |
您最近一年使用:0次
2022-02-28更新
|
848次组卷
|
36卷引用:宁夏青铜峡市高级中学2020-2021学年高一12月月考化学试题
宁夏青铜峡市高级中学2020-2021学年高一12月月考化学试题河南省安阳市第三十六中学2017-2018学年高一上学期期中考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期开学考试化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用广东省2020年普通高中学业水平考试化学合格性考试模拟试题(七)陕西省汉中市龙岗学校2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】江西省九江一中2013-2014学年高一上学期期中考试化学试题广东省珠海市第二中学2019-2020学年高一上学期期中考试化学试题广东省中山纪念中学2019-2020学年高一上学期第二次段考化学试题山东省济宁市邹城兖矿一中2020-2021学年度高一9月月考化学试题吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】30湖南省岳阳市楚雄中学2020-2021学年高一上学期期中考试化学试题广东省湛江市第四中学2020-2021学年高一上学期期中考试化学试题北京市铁路第二中学2020-2021学年高一上学期期中考试化学试题(已下线)【南昌新东方】9. 2020 高一上 铁路一中 刘惠文 钟欣(已下线)【浙江新东方】双师 (55)河北衡水市第十四中学2020-2021学年高一上学期三调考试化学试题天津市滨海新区2020-2021学年高一上学期期末考试化学试题河北省衡水市武邑武罗学校2020-2021学年高一上学期期中考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期第一次摸底考试化学试题河北省衡水市武强中学2020-2021学年高一上学期第一次月考化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期竞赛化学试题黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题四川省成都市第七中学2021-2022学年高一上学期期中考试化学试题四川省攀枝花市第十五中学校2021-2022学年高一上学期期中考试化学试题安徽省安庆市第十中学2021-2022学年高一上学期10月月考化学试题江苏省宿迁市泗阳县实验高级中学2021-2022学年高一上学期第二次调研测试化学试题广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题浙江省绿谷联盟2022-2023学年高一上学期10月份考试化学试题 黑龙江省鹤岗市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学校2022-2023学年高一上学期第二次调研考试化学试题四川省仁寿县铧强中学2021-2022学年高一上学期半期考试化学试题云南省昆明市第八中学2020-2021学年高一上学期期中考试化学试题(已下线)专题七 氧化还原反应天津市宁河区2023-2024学年高一上学期期末考试化学试题
名校
9 . 工业上冶炼锡的第一步反应原理为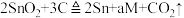 。下列说法中错误的是
。下列说法中错误的是
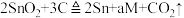 。下列说法中错误的是
。下列说法中错误的是A.该反应中 被还原 被还原 |
| B.a的值为3 |
| C.反应后有两种氧化产物 |
D.每生成1个 转移的电子数为8 转移的电子数为8 |
您最近一年使用:0次
2021-11-14更新
|
259次组卷
|
11卷引用:宁夏青铜峡市高级中学2021-2022学年高一上学期11月测试化学试题
宁夏青铜峡市高级中学2021-2022学年高一上学期11月测试化学试题吉林省榆树一中2017-2018学年高一上学期期中考试化学试题广东省韶关市2017-2018学年高一化学上学期期中试题内蒙古通辽实验中学2017-2018学年高一上学期期末考试化学试题山西省灵丘县一中2017-2018学年高一上学期期中考试化学试卷云南省峨山彝族自治县第一中学2019-2020学年高一上学期期中考试化学试题云南省玉溪市华宁二中2019-2020学年高一上学期期中考试化学试题广东省八校2021-2022学年高一上学期期中调研考试 化学试题 河南省安阳县高级中学2021-2022学年高一上学期期中考试化学试题安徽师范大学附属中学2022-2023学年高一上学期10月选科诊断测试化学试题江苏省南京市第二十九中学2022-2023学年高一上学期10月月考化学试题
名校
10 . 现有下列10种物质:①铝,②纯醋酸,③CO2,④H2SO4,⑤Ba(OH)2,⑥红褐色的氢氧化铁胶体,⑦稀盐酸,⑧NaHSO4,⑨碳酸钙,⑩乙醇,请按要求书写离子方程式或化学方程式,
(1)上述物质中属于电解质的有_______ ,属于非电解质的有_______ ,既不属于电解质也不属于非电解质的有_______ (填序号)。
(2)写出⑧在水中的电离方程式为_______ 。
(3)向沸水中逐滴加入饱和FeCl3溶液,至液体呈透明的红褐色,写出化学方程式_______ 。
(4)已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为_______ 。
(5)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O 还原为Cr3+,该过程的离子方程式为
还原为Cr3+,该过程的离子方程式为_______ 。
(1)上述物质中属于电解质的有
(2)写出⑧在水中的电离方程式为
(3)向沸水中逐滴加入饱和FeCl3溶液,至液体呈透明的红褐色,写出化学方程式
(4)已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为
(5)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O
 还原为Cr3+,该过程的离子方程式为
还原为Cr3+,该过程的离子方程式为
您最近一年使用:0次
2021-10-29更新
|
212次组卷
|
2卷引用:宁夏吴忠中学2021-2022学年高三上学期线上教学测试化学试题



