20-21高一上·北京海淀·期中
名校
1 . Cl2是一种重整的化工原料,在生产、生活和工业上均有很多用途。
(1)可与氢气化合制得盐酸。化学方程式为________________ 。
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为_______________ 。
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为_______________ 。其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是_____________ 。
②Ⅰ中,生成K2MnO4的化学方程式是____________ 。
③Ⅱ中,浸取时用稀KOH溶液的原因是_____________ 。
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为____________ 。
(1)可与氢气化合制得盐酸。化学方程式为
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是
②Ⅰ中,生成K2MnO4的化学方程式是
③Ⅱ中,浸取时用稀KOH溶液的原因是
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO
 +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为
您最近一年使用:0次
解题方法
2 . 工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。图中路线a、b、c是工业制备硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电固氮过程中生成硝酸的途径。
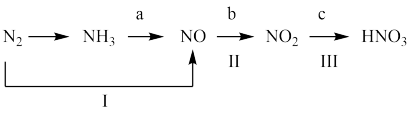
(1)写出N2的—种用途:__________ 。
(2)实验室制取NH3的化学方程式为______ 。
(3)写出工业制硝酸中c过程中反应的化学方程式:______ 。
(4)硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸溶液浓度的不同而有变化。浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
①请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____ 。该反应中发生氧化反应的物质是_____ 。
②64.0gCu与适量的浓HNO3反应,铜全部溶解后,共收集到1mol NO2和NO的混合气体,反应中消耗HNO3的物质的量是____ (填标号)。
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
③实际上HNO3不仅可被还原为NO2或NO,浓度更稀时HNO3还可以被还原为N2O、N2、NH4NO3等。请将3种物质: 、
、 和
和 分别填入下面对应的横线上,组成一个未配平的化学方程式并配平其对应的离子方程式。
分别填入下面对应的横线上,组成一个未配平的化学方程式并配平其对应的离子方程式。
i.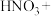
____ 
___ 
___ 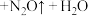
ii.

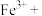
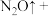

_______________ 。

(1)写出N2的—种用途:
(2)实验室制取NH3的化学方程式为
(3)写出工业制硝酸中c过程中反应的化学方程式:
(4)硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸溶液浓度的不同而有变化。浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
①请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:
②64.0gCu与适量的浓HNO3反应,铜全部溶解后,共收集到1mol NO2和NO的混合气体,反应中消耗HNO3的物质的量是
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
③实际上HNO3不仅可被还原为NO2或NO,浓度更稀时HNO3还可以被还原为N2O、N2、NH4NO3等。请将3种物质:
 、
、 和
和 分别填入下面对应的横线上,组成一个未配平的化学方程式并配平其对应的离子方程式。
分别填入下面对应的横线上,组成一个未配平的化学方程式并配平其对应的离子方程式。i.
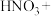


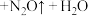
ii.

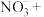

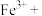
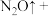

您最近一年使用:0次
名校
解题方法
3 . 氧化还原反应是一类重要的化学反应,在工农业生产、日常生活中都有广泛的用途。请回答下列问题。
Ⅰ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质(甲)为________ (填化学式)。
(2)反应中若产生5个NO分子,则转移电子的数目是________ 。
Ⅱ.亚硝酸钠(NaNO2)像食盐一样有咸味但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应: 。
。
(1)用双线桥法标出该反应中电子转移的方向及数目:________ ,被氧化的原子与被还原的原子数目之比为__________ 。
(2)自来水中的 对人类健康会产生危害碱性条件下Al粉还原
对人类健康会产生危害碱性条件下Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。
_______ 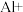
_______ 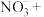
_______ =_______ 
_______ 
_______
Ⅰ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。(1)物质(甲)为
(2)反应中若产生5个NO分子,则转移电子的数目是
Ⅱ.亚硝酸钠(NaNO2)像食盐一样有咸味但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应:
 。
。(1)用双线桥法标出该反应中电子转移的方向及数目:
(2)自来水中的
 对人类健康会产生危害碱性条件下Al粉还原
对人类健康会产生危害碱性条件下Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。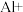
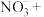


您最近一年使用:0次
2020-09-04更新
|
636次组卷
|
5卷引用:人教版(2019)高一必修第一册第一章 物质及其变化 素养拓展区
人教版(2019)高一必修第一册第一章 物质及其变化 素养拓展区高一必修第一册(苏教2019版)专题3 B 素养拓展区 过综合 专题素养综合检测(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00140】云南省澄江市第一中学2022-2023学年高一上学期期中考试化学试题云南省龙陵县第一中学2022-2023学年高一下学期期末考试化学试题
解题方法
4 . 氮元素的单质和常见的化合物在工、农业生产中用途广泛.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是____________ 。
(2)雷雨时空气中的N2转化为NO,生成物NO是______ 色的气体,________ (填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应。NO2与水反应的化学方程式为_______________________________ 。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 | O2 | Ar | CO2 |
| -196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是
(2)雷雨时空气中的N2转化为NO,生成物NO是
您最近一年使用:0次
2020-01-29更新
|
205次组卷
|
2卷引用:新人教版必修2同步测试:5.2.1一氧化氮和二氧化氮
10-11高一下·安徽宿州·阶段练习
名校
5 . 氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是______ 。
A.制汽轮机叶片 B.制有色玻璃 C.制永久性模具 D.制造柴油机
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式为______ 。
(3)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为______ 。
(1)根据性质,推测氮化硅陶瓷的用途是
A.制汽轮机叶片 B.制有色玻璃 C.制永久性模具 D.制造柴油机
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式为
(3)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为
您最近一年使用:0次



