名校
1 . 硒是一种重要的半导体材料,用富硒铜阳极泥(主要成分为Se、Cu2Se、Ag2Se和银、金等)为原料制备硒的工艺流程如下:
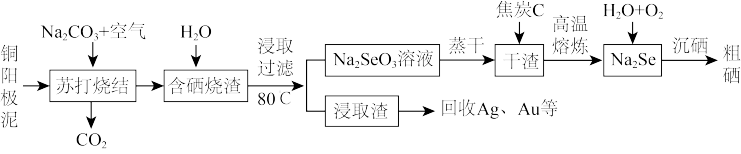
回答下列问题:
(1)试推断34Se在元素周期表中的位置_______ ,据此写出Na2Se的电子式_______ 。
(2)“苏打烧结”时主要发生的化学反应方程式为_______ ;Cu2Se+Na2CO3+2O2=Na2SeO3+CO2+2CuO;Ag2Se+Na2CO3+O2=Na2SeO3+CO2+2Ag。
(3)“含硒烧渣”浸取时需控制温度为80 ℃,则最佳加热方式为_______ ;浸出渣中主要的杂质有_______ 、Ag、Au等。
(4)已知SeO2易溶于水生成H2SeO3,相同温度下,H2SeO3、H2CO3的电离平衡常数如下:
若向Na2CO3溶液中通入过量SeO2,则下列反应的离子方程式正确的是_______。(填字母)
(5)回收硒还可采用另一工艺:即向阳极泥加入浓硫酸,用水吸收生成的SeO2和SO2,试分析此工艺存在的不足之处_______ (答一点即可)。

回答下列问题:
(1)试推断34Se在元素周期表中的位置
(2)“苏打烧结”时主要发生的化学反应方程式为
(3)“含硒烧渣”浸取时需控制温度为80 ℃,则最佳加热方式为
(4)已知SeO2易溶于水生成H2SeO3,相同温度下,H2SeO3、H2CO3的电离平衡常数如下:
| 化学式 | H2SeO3 | H2CO3 |
| 电离平衡常数 | K1=2.7×10-3 K2=2.5×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
A.CO +SeO2 = SeO +SeO2 = SeO +CO2 +CO2 |
B.CO +2SeO2+H2O = 2HSeO +2SeO2+H2O = 2HSeO +CO2 +CO2 |
C.CO +SeO2+H2O = HSeO +SeO2+H2O = HSeO +HCO +HCO |
D.2CO +SeO2+H2O = SeO +SeO2+H2O = SeO +2HCO +2HCO |
您最近一年使用:0次
2 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态,可以对物质的性质进行解释和预测。
Ⅰ、有三种物质: 、
、 、
、
(1)其中氧元素的化合价均为___________ 价。
(2)从氧化剂和还原剂的角度,分析反应中的 作用。请完成下表内容。
作用。请完成下表内容。
(3)由 、
、 的名称可推知
的名称可推知 的名称为
的名称为___________ 。
(4)已知 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式___________ ,由此可推测 也可做供氧剂。
也可做供氧剂。
II、亚硝酸钠 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。
(5)误食 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。
(6)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过150毫克,以此计算,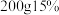 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠___________ 千克。
(7)亚硝酸钠在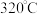 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目___________ 。

Ⅰ、有三种物质:
 、
、 、
、
(1)其中氧元素的化合价均为
(2)从氧化剂和还原剂的角度,分析反应中的
 作用。请完成下表内容。
作用。请完成下表内容。| 序号 | 化学反应方程式 | 作用 |
| ① |  | |
| ② |  | |
| ③ | 既作氧化剂,又作还原剂 |
(3)由
 、
、 的名称可推知
的名称可推知 的名称为
的名称为(4)已知
 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式 也可做供氧剂。
也可做供氧剂。II、亚硝酸钠
 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。(5)误食
 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。A. 被还原 被还原 | B.维生素 具有还原性 具有还原性 |
C.还原性:维生素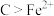 | D. 是还原剂 是还原剂 |
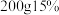 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠(7)亚硝酸钠在
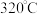 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
您最近一年使用:0次
2022-10-23更新
|
512次组卷
|
2卷引用:广东省中山市2022-2023学年高一上学期期中调研化学试题
3 . 金属钛及其合金密度较小,常温下特别稳定,耐酸碱腐蚀,韧性好,高温下海绵状钛能与氧气反应,是航空、军工、电力等领域的必须金属材料。一种以钛铁矿(主要成份:钛酸亚铁—— )为原料制备金属钛的主要步骤有:
)为原料制备金属钛的主要步骤有:
i.将钛铁矿用浓硫酸溶解,得到含钛化合物和 、
、 的混合溶液
的混合溶液
ii.向步骤i所得的溶液中加入铁粉还原 ,并在273K时析出
,并在273K时析出 晶体以除去铁盐
晶体以除去铁盐
iii.将除去铁盐后的含钛化合物溶液进行一系列处理获得纯净的
iv. 与过量的焦炭、氯气在高温下反应转化为气态
与过量的焦炭、氯气在高温下反应转化为气态 ,然后在充满氩气的容器中用Mg还原,得到海绵状金属钛。
,然后在充满氩气的容器中用Mg还原,得到海绵状金属钛。
回答下列问题
(1) 中Ti元素的化合价为
中Ti元素的化合价为___________ 。
(2)写出步骤ii中向混合溶液加入铁粉时发生反应的离子方程式___________ 。检验加入铁粉后溶液中是否存在 的方法是
的方法是___________ 。
(3)写出步骤iv中 与过量的焦炭、氯气在高温下反应转化为气态
与过量的焦炭、氯气在高温下反应转化为气态 的化学方程式
的化学方程式___________ ,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)在氩气中用镁还原出金属钛,氩气的作用是防止___________ 。
 )为原料制备金属钛的主要步骤有:
)为原料制备金属钛的主要步骤有:i.将钛铁矿用浓硫酸溶解,得到含钛化合物和
 、
、 的混合溶液
的混合溶液ii.向步骤i所得的溶液中加入铁粉还原
 ,并在273K时析出
,并在273K时析出 晶体以除去铁盐
晶体以除去铁盐iii.将除去铁盐后的含钛化合物溶液进行一系列处理获得纯净的

iv.
 与过量的焦炭、氯气在高温下反应转化为气态
与过量的焦炭、氯气在高温下反应转化为气态 ,然后在充满氩气的容器中用Mg还原,得到海绵状金属钛。
,然后在充满氩气的容器中用Mg还原,得到海绵状金属钛。回答下列问题
(1)
 中Ti元素的化合价为
中Ti元素的化合价为(2)写出步骤ii中向混合溶液加入铁粉时发生反应的离子方程式
 的方法是
的方法是(3)写出步骤iv中
 与过量的焦炭、氯气在高温下反应转化为气态
与过量的焦炭、氯气在高温下反应转化为气态 的化学方程式
的化学方程式(4)在氩气中用镁还原出金属钛,氩气的作用是防止
您最近一年使用:0次



