1 . 利用图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为______ ;丁属于______ (“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是_____ (填化学式);根据氯元素的化合价判断,乙物质的性质______ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:甲+H2O 己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是_____ 。
(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为_____ 。NaClO溶液中显碱性原因:______ (用离子方程式表示)。
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为______ 。

(1)丙的化学式为
(2)图中甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:甲+H2O
 己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为
您最近一年使用:0次
名校
解题方法
2 . 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。请写出Cu在空气中生成铜锈的方程式______ 。
(2)继续查阅资料,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学者将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)3Cl属于______ (填“无害锈”和“有害锈”),请解释原因______ 。
(3)文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),请结合如图回答:
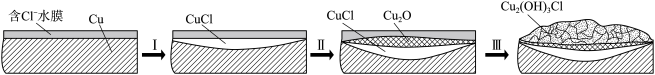
①过程I的正极反应物是______ 。
②过程I负极的电极反应式是______ 。
(4)青铜器的修复有以下三种方法:
i.柠檬酸浸法:将腐蚀文物直接放在2%—3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)3Cl;
iii.BTA保护法:
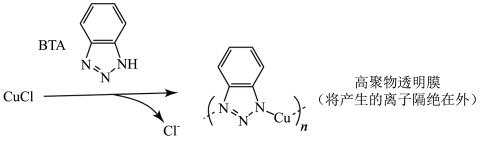
请回答下列问题:
①写出碳酸钠法的离子方程式______ 。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有______ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。请写出Cu在空气中生成铜锈的方程式
(2)继续查阅资料,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学者将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)3Cl属于
(3)文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),请结合如图回答:

①过程I的正极反应物是
②过程I负极的电极反应式是
(4)青铜器的修复有以下三种方法:
i.柠檬酸浸法:将腐蚀文物直接放在2%—3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)3Cl;
iii.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近一年使用:0次
2023-02-03更新
|
195次组卷
|
4卷引用:广东省茂名市电白区2022-2023学年高二上学期期末考试化学(选择性考试)试题
广东省茂名市电白区2022-2023学年高二上学期期末考试化学(选择性考试)试题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)江西省贵溪市实验中学2023-2024学年高三上学期10月第二次月考化学试题
名校
解题方法
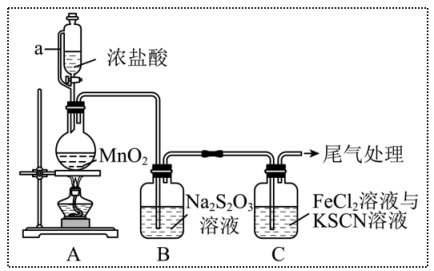
3 . 某同学用如图装置制备Cl2并探究其性质。查阅资料知:
i. 酸性条件下与H+迅速反应生成S和SO2
酸性条件下与H+迅速反应生成S和SO2
ii. 有较强的还原性,
有较强的还原性, 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_______ ;尾气处理用_______ (填化学式)溶液吸收。
(2)装置A中制备Cl2的化学方程式为_______ 。
(3)上述装置中存在一处缺陷,会干扰Cl2和Na2S2O3性质的探究,改进的方法是_______ 。
(4)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_______ 。
(5)装置C中溶液颜色先变为血红色,一段时间后褪色。某同学对褪色原因提出假设:
①假设1:Fe3+被Cl2氧化为更高价态;
②假设2:_______ ;
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,_______ (写出操作及现象)说明假设2成立。

i.
 酸性条件下与H+迅速反应生成S和SO2
酸性条件下与H+迅速反应生成S和SO2ii.
 有较强的还原性,
有较强的还原性, 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)装置A中制备Cl2的化学方程式为
(3)上述装置中存在一处缺陷,会干扰Cl2和Na2S2O3性质的探究,改进的方法是
(4)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(5)装置C中溶液颜色先变为血红色,一段时间后褪色。某同学对褪色原因提出假设:
①假设1:Fe3+被Cl2氧化为更高价态;
②假设2:
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,
您最近一年使用:0次
名校
解题方法
4 . 2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)①写出新制氯水中,具有氧化性的含氯微粒有_______ ;
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4 +16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑+8H2O,15.8 g KMnO4能和_______ mol HCl发生上述反应、产生的Cl2在标准状况下的体积为_______ L;
③实验室还可以利用如下反应制取氯气:KClO3 + 6HCl(浓) = KCl + 3Cl2↑ + 3H2O。若制取标准状况下6.72 L氯气,反应过程中转移电子的物质的量为_______ mol;
(2)常温下,氯气与消石灰浊液反应得漂白精,Ca(ClO)2是漂白精的有效成分,在此次抗击新冠病毒中发挥了重要作用 ,浸泡衣物时加入漂白精在空气中放置一段时间漂白效果更好,原因用化学方程式表示为:_______ ;
(3)根据如图的溶解度曲线,回答下列问题。
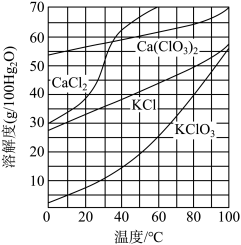
①向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出,若溶液中KClO3的含量为100 g·L-1,从该溶液中得到KClO3固体的方法是_______ 。
② KClO3与SO2在强酸性条件下可反应制得ClO2,SO2被氧化为SO ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(1)①写出新制氯水中,具有氧化性的含氯微粒有
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4 +16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑+8H2O,15.8 g KMnO4能和
③实验室还可以利用如下反应制取氯气:KClO3 + 6HCl(浓) = KCl + 3Cl2↑ + 3H2O。若制取标准状况下6.72 L氯气,反应过程中转移电子的物质的量为
(2)常温下,氯气与消石灰浊液反应得漂白精,Ca(ClO)2是漂白精的有效成分,在此次抗击新冠病毒中发挥了重要作用 ,浸泡衣物时加入漂白精在空气中放置一段时间漂白效果更好,原因用化学方程式表示为:
(3)根据如图的溶解度曲线,回答下列问题。

①向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出,若溶液中KClO3的含量为100 g·L-1,从该溶液中得到KClO3固体的方法是
② KClO3与SO2在强酸性条件下可反应制得ClO2,SO2被氧化为SO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
5 . 明矾[ ]在造纸等方面应用广泛。工业上以废易拉罐(主要成分为Al和Fe)为原料制备明矾的工艺流程如图:
]在造纸等方面应用广泛。工业上以废易拉罐(主要成分为Al和Fe)为原料制备明矾的工艺流程如图:
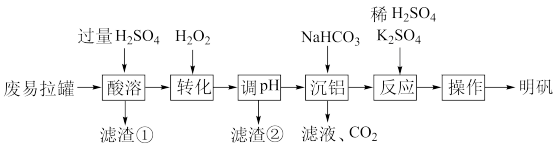
已知:不同温度 的溶解度:
的溶解度:
(1)“酸溶”中溶液中主要的金属离子有______ 、 、
、 。
。
(2)“转化”中 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为______ 。
(3)“调pH”约为3.7,滤渣②的主要成分是 ,“调pH”的目的是
,“调pH”的目的是______ 。
(4)“沉铝”中加入 目的是将
目的是将 转化为
转化为 ,补全该反应的离子方程式
,补全该反应的离子方程式______ 。
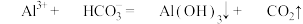
(5)“操作”包括______ 、______ 、过滤、洗涤、干燥可得到明矾晶体。
(6)某工厂用 kg废易拉罐(含Al 5.4%)制备
kg废易拉罐(含Al 5.4%)制备 (相对分子质量为474),最终得到产品
(相对分子质量为474),最终得到产品 kg,产率为
kg,产率为______ (列出计算式,不需运算)
 ]在造纸等方面应用广泛。工业上以废易拉罐(主要成分为Al和Fe)为原料制备明矾的工艺流程如图:
]在造纸等方面应用广泛。工业上以废易拉罐(主要成分为Al和Fe)为原料制备明矾的工艺流程如图:
已知:不同温度
 的溶解度:
的溶解度:温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
| 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
 、
、 。
。(2)“转化”中
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为(3)“调pH”约为3.7,滤渣②的主要成分是
 ,“调pH”的目的是
,“调pH”的目的是(4)“沉铝”中加入
 目的是将
目的是将 转化为
转化为 ,补全该反应的离子方程式
,补全该反应的离子方程式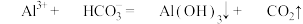
(5)“操作”包括
(6)某工厂用
 kg废易拉罐(含Al 5.4%)制备
kg废易拉罐(含Al 5.4%)制备 (相对分子质量为474),最终得到产品
(相对分子质量为474),最终得到产品 kg,产率为
kg,产率为
您最近一年使用:0次
名校
解题方法
6 . 亚硝酸钠( )是一种常见的食品添加剂。某实验小组制备
)是一种常见的食品添加剂。某实验小组制备 并对其性质进行探究。已知:
并对其性质进行探究。已知: 与
与 反应,可生成
反应,可生成 白色沉淀或无色配离子。
白色沉淀或无色配离子。
回答下列问题:
I. 的制取(夹持装置略)
的制取(夹持装置略)

向装置A中通入一段时间 ,再通入NO和
,再通入NO和 混合气体,待
混合气体,待 反应完全后,将所得溶液经系列操作,得到
反应完全后,将所得溶液经系列操作,得到 白色固体。
白色固体。
(1)图中作反应器盛放碳酸钠溶液的仪器名称是_______ 。
(2)通入NO和 混合气体之前先通入一段时间
混合气体之前先通入一段时间 的目的是
的目的是_______ 。
(3)制取 的化学方程式是
的化学方程式是_______ ,常温下 溶液呈碱性的原因是
溶液呈碱性的原因是_______ (用离子方程式表示)。
II. 性质探究
性质探究
将实验i制取的 固体配制成约
固体配制成约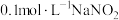 溶液,进行实验ii和iii。
溶液,进行实验ii和iii。

(4)由实验ii的现象得出结论:白色沉淀的生成与_______ 有关。

(5)①酸性条件下, 氧化
氧化 的离子方程式是
的离子方程式是_______ 。
②甲同学认为,依据实验iii的现象可以得出结论:该条件下, 能氧化
能氧化 。乙同学则认为试验i中制得的
。乙同学则认为试验i中制得的 溶液中可能含有副产物
溶液中可能含有副产物_______ , 在酸性条件下也能氧化
在酸性条件下也能氧化 ,仅凭实验iii不能得出上述结论。
,仅凭实验iii不能得出上述结论。
 )是一种常见的食品添加剂。某实验小组制备
)是一种常见的食品添加剂。某实验小组制备 并对其性质进行探究。已知:
并对其性质进行探究。已知: 与
与 反应,可生成
反应,可生成 白色沉淀或无色配离子。
白色沉淀或无色配离子。回答下列问题:
I.
 的制取(夹持装置略)
的制取(夹持装置略)
向装置A中通入一段时间
 ,再通入NO和
,再通入NO和 混合气体,待
混合气体,待 反应完全后,将所得溶液经系列操作,得到
反应完全后,将所得溶液经系列操作,得到 白色固体。
白色固体。(1)图中作反应器盛放碳酸钠溶液的仪器名称是
(2)通入NO和
 混合气体之前先通入一段时间
混合气体之前先通入一段时间 的目的是
的目的是(3)制取
 的化学方程式是
的化学方程式是 溶液呈碱性的原因是
溶液呈碱性的原因是II.
 性质探究
性质探究将实验i制取的
 固体配制成约
固体配制成约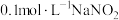 溶液,进行实验ii和iii。
溶液,进行实验ii和iii。
(4)由实验ii的现象得出结论:白色沉淀的生成与

(5)①酸性条件下,
 氧化
氧化 的离子方程式是
的离子方程式是②甲同学认为,依据实验iii的现象可以得出结论:该条件下,
 能氧化
能氧化 。乙同学则认为试验i中制得的
。乙同学则认为试验i中制得的 溶液中可能含有副产物
溶液中可能含有副产物 在酸性条件下也能氧化
在酸性条件下也能氧化 ,仅凭实验iii不能得出上述结论。
,仅凭实验iii不能得出上述结论。
您最近一年使用:0次
解题方法
7 . 研究小组用氯气氧化K2MnO4制备KMnO4 (加热装置已省略),并利用产品进行实验探究。

(1)实验过程中装置连接顺序为_______ ,装置C的作用为_______ 。
(2)加热反应一段时间,观察到装置B中溶液由墨绿色变成紫红色后关闭分液漏斗活塞,停止加热,将KMnO4溶液减压过滤后,倒入蒸发皿中水浴蒸发浓缩、抽滤即得紫红色KMnO4固体。
①装置A中最合适的反应温度为80℃,需要采取的实验方法是_______ 。
②停止加热后,拆卸装置前应采取的实验操作为_______ 。
(3)小组用提纯后的KMnO4配成溶液与H2C2O4反应,探究H2C2O4浓度对反应速率的影响。利用下列试剂完成实验设计。提供试剂:蒸馏水,0.01 mol∙L-1 KMnO4溶液、0.2 mol∙L-1 H2C2O4溶液、0.5 mol∙L-1 H2SO4溶液
①实验中t1<t2,则a=_______ ,b=_______ 。
②在实验中Ⅰ、Ⅱ中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后逐渐加快。某同学查阅得知,存在如下反应历程

反应一段时间后褪色速度突然加快的原因为_______ ,历程中生成CO2的离子反应方程式为_______ 。
(4)取a g实验制得的KMnO4固体溶于水,加入过量的饱和Ba(OH)2溶液(KMnO4不参与反应)沉降 ,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为
,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为_______ (用含a、b的代数式表示)。[已知: ,
, ]
]

(1)实验过程中装置连接顺序为
(2)加热反应一段时间,观察到装置B中溶液由墨绿色变成紫红色后关闭分液漏斗活塞,停止加热,将KMnO4溶液减压过滤后,倒入蒸发皿中水浴蒸发浓缩、抽滤即得紫红色KMnO4固体。
①装置A中最合适的反应温度为80℃,需要采取的实验方法是
②停止加热后,拆卸装置前应采取的实验操作为
(3)小组用提纯后的KMnO4配成溶液与H2C2O4反应,探究H2C2O4浓度对反应速率的影响。利用下列试剂完成实验设计。提供试剂:蒸馏水,0.01 mol∙L-1 KMnO4溶液、0.2 mol∙L-1 H2C2O4溶液、0.5 mol∙L-1 H2SO4溶液
| 编号 | 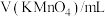 |  | 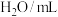 | 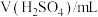 | 褪色时间/s |
| Ⅰ | 5.0 | 5.0 | 3 | 2 |  |
| Ⅱ | 5.0 | a | b | 2 |  |
②在实验中Ⅰ、Ⅱ中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后逐渐加快。某同学查阅得知,存在如下反应历程

反应一段时间后褪色速度突然加快的原因为
(4)取a g实验制得的KMnO4固体溶于水,加入过量的饱和Ba(OH)2溶液(KMnO4不参与反应)沉降
 ,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为
,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为 ,
, ]
]
您最近一年使用:0次
8 . 以镁铝复合氧化物(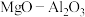 )为载体的负载型镍铜双金属催化剂(
)为载体的负载型镍铜双金属催化剂(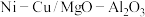 )是一种新型高效加氢或脱氢催化剂,其制备流程如下:
)是一种新型高效加氢或脱氢催化剂,其制备流程如下:
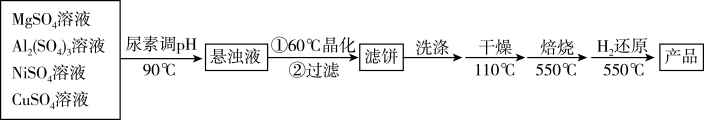
回答下列问题:
(1)在加热条件下,尿素 在水中发生非氧化还原反应,放出
在水中发生非氧化还原反应,放出_______ 和_______ 两种气体(写化学式)。
(2)“晶化”过程中,需保持恒温60℃,可采用的加热方式为_______ 。
(3)“洗涤”过程中,检验滤饼是否洗净的方法是_______ 。
(4)“还原”过程中所发生反应的化学方程式为_______ 。
(5) 溶液在强碱溶液中被NaClO氧化可得NiOOH沉淀,请写出对应离子方程式
溶液在强碱溶液中被NaClO氧化可得NiOOH沉淀,请写出对应离子方程式____ 。
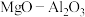 )为载体的负载型镍铜双金属催化剂(
)为载体的负载型镍铜双金属催化剂(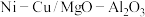 )是一种新型高效加氢或脱氢催化剂,其制备流程如下:
)是一种新型高效加氢或脱氢催化剂,其制备流程如下:
回答下列问题:
(1)在加热条件下,尿素
 在水中发生非氧化还原反应,放出
在水中发生非氧化还原反应,放出(2)“晶化”过程中,需保持恒温60℃,可采用的加热方式为
(3)“洗涤”过程中,检验滤饼是否洗净的方法是
(4)“还原”过程中所发生反应的化学方程式为
(5)
 溶液在强碱溶液中被NaClO氧化可得NiOOH沉淀,请写出对应离子方程式
溶液在强碱溶液中被NaClO氧化可得NiOOH沉淀,请写出对应离子方程式
您最近一年使用:0次
名校
解题方法
9 . 天宫一号于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式:2KNO3+S+3C═K2S+N2↑+3CO2↑。上述反应中被还原的元素是_______ ;若反应生成6个CO2,则转移的电子的个数为_______ ;
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵(NH4ClO4)、铝粉复合推进剂。其中高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,已知其中一种气体产物为HCl,还有2种产物是空气中的主要成分,请写出该反应的化学方程式:_______ ;
(3)火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式_______ 。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式:2KNO3+S+3C═K2S+N2↑+3CO2↑。上述反应中被还原的元素是
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵(NH4ClO4)、铝粉复合推进剂。其中高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,已知其中一种气体产物为HCl,还有2种产物是空气中的主要成分,请写出该反应的化学方程式:
(3)火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式
您最近一年使用:0次
解题方法
10 . 硫酸高铈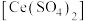 是一种常见的氧化剂。以氟碳铈矿粉(主要成分为
是一种常见的氧化剂。以氟碳铈矿粉(主要成分为 )为原料制取
)为原料制取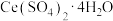 的一种工艺如下:
的一种工艺如下:
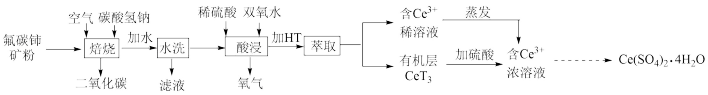
已知: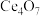 中
中 的化合价为+3、+4价,难溶于水,但可与酸反应生成盐和水。
的化合价为+3、+4价,难溶于水,但可与酸反应生成盐和水。
回答下列问题:
(1)蒸发操作中玻璃棒的作用是_______ 。
(2)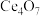 中
中
_______ 。
(3)“焙烧”中, 转化为
转化为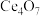 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
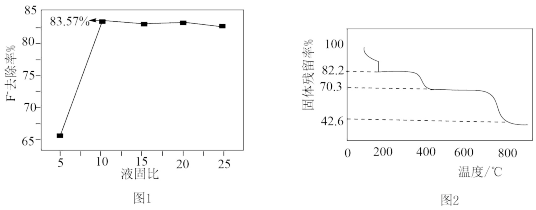
(4)“水洗”时F-的去除率与液固比变化关系如图1所示,除去F-的最佳液固比为_______ 。
(5)“酸浸”中发生反应的离子方程式为_____ ,此操作不能使用玻璃烧杯的原因是_______ 。
(6)“萃取”过程可表示为 。向
。向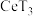 (有机层)中加入硫酸能获得含
(有机层)中加入硫酸能获得含 的浓溶液,从平衡角度解释其原因:
的浓溶液,从平衡角度解释其原因:_______ 。
(7)将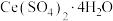 (摩尔质量为
(摩尔质量为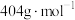 )在空气中加热,样品的固体残留率(残留率
)在空气中加热,样品的固体残留率(残留率 )随温度的变化如图2所示。当固体残留率为70.3%时,所得固体可能为
)随温度的变化如图2所示。当固体残留率为70.3%时,所得固体可能为_______ (填标号)。
A. B.
B. C.
C.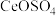
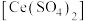 是一种常见的氧化剂。以氟碳铈矿粉(主要成分为
是一种常见的氧化剂。以氟碳铈矿粉(主要成分为 )为原料制取
)为原料制取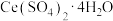 的一种工艺如下:
的一种工艺如下:
已知:
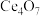 中
中 的化合价为+3、+4价,难溶于水,但可与酸反应生成盐和水。
的化合价为+3、+4价,难溶于水,但可与酸反应生成盐和水。回答下列问题:
(1)蒸发操作中玻璃棒的作用是
(2)
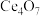 中
中
(3)“焙烧”中,
 转化为
转化为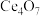 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(4)“水洗”时F-的去除率与液固比变化关系如图1所示,除去F-的最佳液固比为

(5)“酸浸”中发生反应的离子方程式为
(6)“萃取”过程可表示为
 。向
。向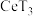 (有机层)中加入硫酸能获得含
(有机层)中加入硫酸能获得含 的浓溶液,从平衡角度解释其原因:
的浓溶液,从平衡角度解释其原因:(7)将
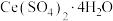 (摩尔质量为
(摩尔质量为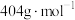 )在空气中加热,样品的固体残留率(残留率
)在空气中加热,样品的固体残留率(残留率 )随温度的变化如图2所示。当固体残留率为70.3%时,所得固体可能为
)随温度的变化如图2所示。当固体残留率为70.3%时,所得固体可能为A.
 B.
B. C.
C.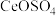
您最近一年使用:0次



