名校
解题方法
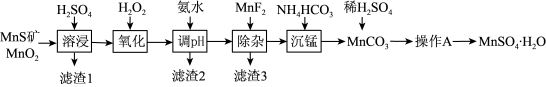
1 . 硫酸锰(MnSO4•H2O)是一种粉色晶体,易溶于水,不溶于乙醇,是重要的微量元素肥料之一,工业上由天然二氧化锰与硫化锰矿(还含Fe、Al、Mg、Si等元素的氧化物)制备硫酸锰的工艺如图所示。回答下列问题:
②相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
(1)“溶浸”前需将矿石研成粉末,其目的是_______ 。“滤渣1”中含有S和_______ ;“溶浸”时两种含锰化合物与H2SO4反应的化学方程式为_______ 。
(2)“氧化”时添加适量的MnO2的作用是_______ (用离子方程式表示),若省略“氧化”步骤,造成的后果是_______ 。
(3)加入MnF2的目的是_______ 。
(4)滤液经过_______ (写操作A的名称),可得到粉红色MnSO4•H2O晶体。
(5)构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。_______ 。
②如图晶体的化学式为_______ ;该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为_______ g•cm-3(用NA表示阿伏加德罗常数,列式即可)。
②相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“溶浸”前需将矿石研成粉末,其目的是
(2)“氧化”时添加适量的MnO2的作用是
(3)加入MnF2的目的是
(4)滤液经过
(5)构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
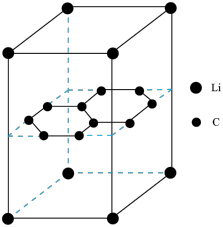
②如图晶体的化学式为
您最近一年使用:0次
2 . 随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示, 下列说法正确的是


| A.反应中 NO 为氧化剂, N2为氧化产物 |
| B.汽车尾气的主要污染成分包括 CO 、NO 和 N2 |
| C.NO 和 O2必须在催化剂表面才能反应 |
| D.催化转化总化反应氧化剂与还原剂的物质的量之比为: 3:4 |
您最近一年使用:0次
名校
解题方法
3 . 下图为从铜转炉烟灰[主要含有ZnO,还有少量的Fe(II)、Pb、Cu、As元素]制取活性氧化锌的流程。请回答以下问题:

已知:①活性炭主要吸附有机质;
②25℃时,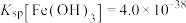 ;
;
③氨体系环境中锌元素以[Zn(NH3)4]2+形式存在;
④部分金属离子开始沉淀和完全沉淀的pH:
(1)Pb(OH)Cl中Pb的化合价为_______ 。
(2)浸取温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵最适宜的浓度为_______ mol·L-1。

(3)加入适量KMnO4溶液的目的是除去铁元素的同时溶液中不会有明显的锰元素残留,写出除铁步骤的离子方程式:_______ ,常温下此时体系中Fe3+残留最大浓度为_______ mol·L-1。
(4)已知“除杂3”是利用置换反应进行除杂,则“滤渣III”的主要成分为_______ (填化学式)。
(5)“沉锌”反应的离子方程式为_______ 。

已知:①活性炭主要吸附有机质;
②25℃时,
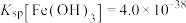 ;
;③氨体系环境中锌元素以[Zn(NH3)4]2+形式存在;
④部分金属离子开始沉淀和完全沉淀的pH:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 4.5 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 6.4 | 10.1 |
(1)Pb(OH)Cl中Pb的化合价为
(2)浸取温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵最适宜的浓度为

(3)加入适量KMnO4溶液的目的是除去铁元素的同时溶液中不会有明显的锰元素残留,写出除铁步骤的离子方程式:
(4)已知“除杂3”是利用置换反应进行除杂,则“滤渣III”的主要成分为
(5)“沉锌”反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 纳米氧化锌作为一种新型功能材料,在橡胶、涂料、陶瓷、防晒化妆品等领域广泛应用。以废辞电池预处理物(主要成分为ZnO,另含少量 、CuO、
、CuO、 、MnO等)为原料可生产制备纳米ZnO的流程如图所示。
、MnO等)为原料可生产制备纳米ZnO的流程如图所示。
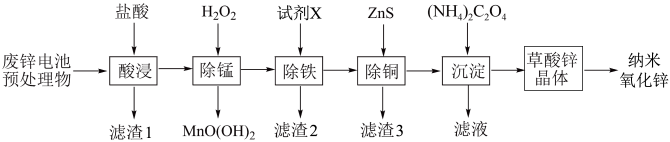
已知:ZnS和Cus的Ksp分别为 、
、 。
。
(1)“酸浸”过程中,为了提高浸取效率,可采取的措施有___________ (写出其中一条即可)。
(2)滤渣1的主要成分是___________ 。
(3)“除锰”过程中 的作用是
的作用是___________ (用离子方程式表示)。
(4)“除铁”过程中加入试剂X可能是___________(填字母序号)。
(5)“除铜”的原理是 ,常温下,该反应的平衡常数为
,常温下,该反应的平衡常数为___________ 。
(6)在通风橱中,将草酸锌晶体置于陶瓷仪器___________ (填仪器名称)中加热分解可制得ZnO。实验室中测定纳米ZnO的晶体结构可用___________ 法(填方法名称)。
(7)草酸锌晶体( )加热过程中固体质量随温度的变化情况如图所示。图中A转化为B的过程中发生反应的化学方程式为
)加热过程中固体质量随温度的变化情况如图所示。图中A转化为B的过程中发生反应的化学方程式为___________ 。

 、CuO、
、CuO、 、MnO等)为原料可生产制备纳米ZnO的流程如图所示。
、MnO等)为原料可生产制备纳米ZnO的流程如图所示。
已知:ZnS和Cus的Ksp分别为
 、
、 。
。(1)“酸浸”过程中,为了提高浸取效率,可采取的措施有
(2)滤渣1的主要成分是
(3)“除锰”过程中
 的作用是
的作用是(4)“除铁”过程中加入试剂X可能是___________(填字母序号)。
A. | B. | C.NaOH | D. |
 ,常温下,该反应的平衡常数为
,常温下,该反应的平衡常数为(6)在通风橱中,将草酸锌晶体置于陶瓷仪器
(7)草酸锌晶体(
 )加热过程中固体质量随温度的变化情况如图所示。图中A转化为B的过程中发生反应的化学方程式为
)加热过程中固体质量随温度的变化情况如图所示。图中A转化为B的过程中发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 化学从微观层次认识物质,以符号形式描述物质。下列实验对应的离子方程式书写正确的是
A.向饱和氯化钠溶液中依次通入足量 和 和 : :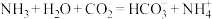 |
B.向碳酸氢钠溶液中滴加少量石灰水: |
C.同物质的量浓度同体积的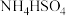 溶液与 溶液与 溶液混合: 溶液混合: |
D.用亚硫酸钠溶液吸收少量氯气: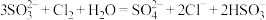 |
您最近一年使用:0次
2022-05-24更新
|
477次组卷
|
5卷引用:广东省汕头市2022届高三下学期第三次模拟考试化学试题
广东省汕头市2022届高三下学期第三次模拟考试化学试题(已下线)专题03 离子反应-2022年高考真题模拟题分项汇编(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省济源市高级中学2023-2024学年高三上学期9月高考模拟检测理科综合试题-高中化学
名校
解题方法
6 . 用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:

(1)下列措施无法加快浸取速率的是_______。(填字母)
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______ 。
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是_______。
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______ 。
(5)滤液Ⅱ所含溶质主要是_______ (填化学式)。
(6)该流程中可循环使用的物质是_______ (填化学式)。

(1)下列措施无法加快浸取速率的是_______。(填字母)
| A.延长浸取时间 | B.将辉铜矿粉碎 |
| C.充分搅拌 | D.适当增大硫酸浓度 |
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是_______。
| A.CO2 | B.CuO | C.氨水 | D.HCl |
(5)滤液Ⅱ所含溶质主要是
(6)该流程中可循环使用的物质是
您最近一年使用:0次
2022-04-26更新
|
325次组卷
|
2卷引用:广东省汕头市金山中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
7 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图:

回答下列问题:
(1)硒(Se)与硫为同族元素,基态Se原子的简化电子排布式为____ ;镓(Ga)和铟(In)位于元素周期表第ⅢA族,属于____ 区;基态Cu原子的价电子排布图为____ 。
(2)CuIn0.5Ga0.5Se2中Cu的化合价为____ ,高温焙烧得到的烧渣主要成分是氧化物,则“酸浸氧化”发生的主要氧化还原反应的化学方程式为____ 。
(3)SOCl2分子空间结构为____ 形,“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO 是否洗净的试剂是
是否洗净的试剂是___ 、____ 。(填化学式)
(4)“高温气相沉积”过程中发生的化学反应方程式为____ 。
(5)25℃时,已知:Kb(NH3·H2O)≈2.0×10-5,Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,Ksp[Cu(OH)2]≈1.0×10-20,“浸出液”中c(Cu2+)=0.01mol·L-1。当金属阳离子浓度小于1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为____ (保留一位小数);为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3+NH3·H2O [Ga(OH)4]-+NH
[Ga(OH)4]-+NH 的平衡常数K=
的平衡常数K=___ 。(已知:Ga3++4OH- [Ga(OH)4]-,K′=
[Ga(OH)4]-,K′=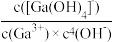 ≈1.0×1034)
≈1.0×1034)

回答下列问题:
(1)硒(Se)与硫为同族元素,基态Se原子的简化电子排布式为
(2)CuIn0.5Ga0.5Se2中Cu的化合价为
(3)SOCl2分子空间结构为
 是否洗净的试剂是
是否洗净的试剂是(4)“高温气相沉积”过程中发生的化学反应方程式为
(5)25℃时,已知:Kb(NH3·H2O)≈2.0×10-5,Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,Ksp[Cu(OH)2]≈1.0×10-20,“浸出液”中c(Cu2+)=0.01mol·L-1。当金属阳离子浓度小于1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为
 [Ga(OH)4]-+NH
[Ga(OH)4]-+NH 的平衡常数K=
的平衡常数K= [Ga(OH)4]-,K′=
[Ga(OH)4]-,K′=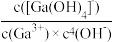 ≈1.0×1034)
≈1.0×1034)
您最近一年使用:0次
名校
8 . 二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒(IV)碱式碳酸铵晶体,过程如下:
V2O5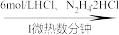 VOCl2溶液
VOCl2溶液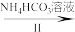 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O
回答下列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为_______ 。已知:氧化性:V2O5>Cl2,则加入N2H4·2HCl的作用是_______ 。
(2)步骤II可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。
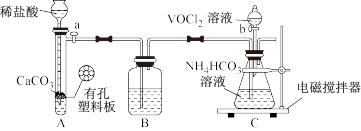
装置B中盛装的试剂是_______ ;向C中通入是CO2的作用是_______ 。
(3)加完VOCl2溶液后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫色晶体,过滤。此时紫色晶体上残留的杂质离子主要为_______ ,接下来的简要操作是_______ ,最后用乙醚洗涤2-3次,干燥后称重。(所用药品为:饱和NH4HCO3溶液,无水乙醇)。
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。称量5.1000g样品于锥形瓶中,用硫酸溶液溶解后得到含VO2+的溶液,加稍过量的0.0200 mol/L的KMnO4溶液将VO2+氧化为VO ,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应:
,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应: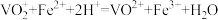 )
)
①在该实验条件下,还原剂X与Mn2+、VO2+的还原性由大到小为_______ 。
②粗产品中钒元素的质量分数为_______ 。(保留四位有效数字)
V2O5
 VOCl2溶液
VOCl2溶液 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O回答下列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为
(2)步骤II可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。

装置B中盛装的试剂是
(3)加完VOCl2溶液后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫色晶体,过滤。此时紫色晶体上残留的杂质离子主要为
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。称量5.1000g样品于锥形瓶中,用硫酸溶液溶解后得到含VO2+的溶液,加稍过量的0.0200 mol/L的KMnO4溶液将VO2+氧化为VO
 ,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应:
,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应: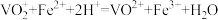 )
)①在该实验条件下,还原剂X与Mn2+、VO2+的还原性由大到小为
②粗产品中钒元素的质量分数为
您最近一年使用:0次
2022-03-22更新
|
1074次组卷
|
5卷引用:广东省汕头市第一中学2022届高三下学期4月月考化学试题
解题方法
9 . 砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”就是采用砷化镓薄膜电池来供电。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
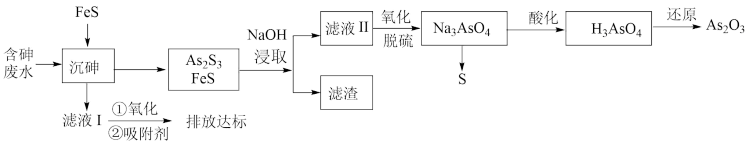
已知:
Ⅰ.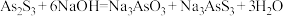
Ⅱ.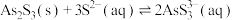
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原
(1) 中砷元素的化合价为
中砷元素的化合价为___________ 价。
(2)“沉砷”过程中FeS是否可以用过量的 替换
替换___________ (填“是”或“否”);请从平衡移动的角度解释原因:___________ 。
(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式___________ 。
(4)用 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有___________ 。
(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。
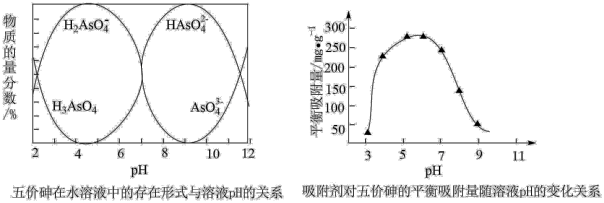
当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因_____ 。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为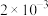 mol/L,则溶液中
mol/L,则溶液中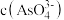 的浓度为
的浓度为_____ mol/L。该处理后的溶液是否符合国家排放标准___________ (填“是”或“否”)。(已知: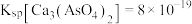 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
 )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
已知:
Ⅰ.
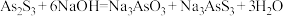
Ⅱ.
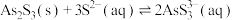
Ⅲ.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原(1)
 中砷元素的化合价为
中砷元素的化合价为(2)“沉砷”过程中FeS是否可以用过量的
 替换
替换(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式
(4)用
 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。

当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为
 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为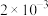 mol/L,则溶液中
mol/L,则溶液中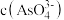 的浓度为
的浓度为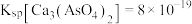 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
您最近一年使用:0次
解题方法
10 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,图为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:

已知:① 浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
② 流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)Co2O3中Co元素的化合价为_______ 。
(2)NaClO3发生的主要离子反应方程式为_______ ;若不慎加入过量NaClO3,可能会生成有毒气体是_______ (写化学式)。
(3)沉淀Ⅰ的主要成分为_______ 、_______ 。
(4)若萃取剂层含锰元素,则加入NaF溶液的目的是_______ 。
(5)“水层”中含有CoCl2,写出生成CoC2O4·2H2O的化学反应方程式为_______ 。
(6)操作Ⅰ包括:往水层中加入浓盐酸调整pH为2~3,_______ 、_______ 、过滤、洗涤、干燥。
(7)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_______ 。(答一条即可)

已知:① 浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
② 流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3发生的主要离子反应方程式为
(3)沉淀Ⅰ的主要成分为
(4)若萃取剂层含锰元素,则加入NaF溶液的目的是
(5)“水层”中含有CoCl2,写出生成CoC2O4·2H2O的化学反应方程式为
(6)操作Ⅰ包括:往水层中加入浓盐酸调整pH为2~3,
(7)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次



