名校
解题方法
1 . 六聚偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由Ca3(PO4)2、焦炭、石英砂为原料制备六偏磷酸钠的方法如下:
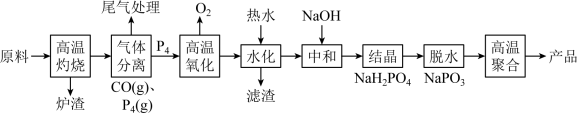
回答下列问题:
(1)六聚偏磷酸钠[(NaPO3)6]中的磷元素的化合价是_______ 。
(2)“高温灼烧”发生反应的化学方程式是_______ 。
(3)因白磷(P4)易自燃,故通常保存在冷水中。在“气体分离”环节中得到白磷固体比较合理的操作是_______ 。
(4)经分析,所得到的白磷中含有相对较多的Pb和含量相对少量的As元素。在“高温氧化”时As、Pb会被氧化成As2O5、PbO,随后在“水化”(产物是H3PO4)过程中转化为两种难溶性盐被除去,则两种滤渣的主要成分是_______ 、_______ (填化学式)。
(5)已知室温下H3PO4的Ka1=7.5×10-3、Ka2=6.4×10-8、Ka3=4.4×10-13,且lg3.2=0.5。
①若直接将白磷与足量NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体(PH3)。写出该化学方程式_______ 。
②欲得到室温下0.5mol/LNaH2PO4溶液,则“中和”时需加适量NaOH固体调溶液pH约为_______ (结果保留两位小数)。
(6)将白磷的氧化产物(P4O10)与纯碱混合加热是工业上制备偏磷酸钠的另一种方法,该方法的化学方程式是_______ 。

回答下列问题:
(1)六聚偏磷酸钠[(NaPO3)6]中的磷元素的化合价是
(2)“高温灼烧”发生反应的化学方程式是
(3)因白磷(P4)易自燃,故通常保存在冷水中。在“气体分离”环节中得到白磷固体比较合理的操作是
(4)经分析,所得到的白磷中含有相对较多的Pb和含量相对少量的As元素。在“高温氧化”时As、Pb会被氧化成As2O5、PbO,随后在“水化”(产物是H3PO4)过程中转化为两种难溶性盐被除去,则两种滤渣的主要成分是
(5)已知室温下H3PO4的Ka1=7.5×10-3、Ka2=6.4×10-8、Ka3=4.4×10-13,且lg3.2=0.5。
①若直接将白磷与足量NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体(PH3)。写出该化学方程式
②欲得到室温下0.5mol/LNaH2PO4溶液,则“中和”时需加适量NaOH固体调溶液pH约为
(6)将白磷的氧化产物(P4O10)与纯碱混合加热是工业上制备偏磷酸钠的另一种方法,该方法的化学方程式是
您最近一年使用:0次
名校
解题方法
2 . 某小组研究不同pH下用NaClO氧化废水中的氨氮(用硝酸铵模拟),使其转化为无污染的气体,设计试剂用量如下表。已知HClO的氧化性比ClO-的氧化性更强,以下说法错误的是
| pH | 0.100mol·L-1 NH4NO3溶液/(mL) | 0.100mol·L-1 NaClO溶液/(mL) | 0.200mol·L-1 硫酸/(mL) | 蒸馏水 /(mL) | 氨氮去除率 /(%) |
| 1.0 | 10.00 | 10.00 | 10.00 | 10.00 | 89 |
| 2.0 | 10.00 | 10.00 | V1 | V2 | 75 |
| 6.0 | …… | …… | …… | …… | 85 |
| A.V1=2.00 |
B.pH=1反应的离子方程式:3ClO-+2NH =3Cl-+N2↑+3H2O+2H+ =3Cl-+N2↑+3H2O+2H+ |
| C.pH从1升高到2,氨氮去除率降低的原因是更多的HClO转化为ClO- |
| D.将氨氮废水的pH控制在6再进行处理更容易达到排放标准 |
您最近一年使用:0次
名校
3 . 某含硫酸的酸性工业废水中含有 。光照下,草酸(化学式为
。光照下,草酸(化学式为 ,是二元弱酸)能将其中的
,是二元弱酸)能将其中的 转化为
转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾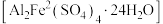 即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在
即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在 下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始
下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始 和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
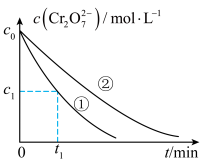
测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(1)写出草酸与重铬酸钾反应的离子方程式:_______ 。
(2)
_______ ,
_______ ,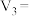
_______ 。
(3)实验①和②的结果表明_______ 。
(4)实验①中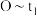 时段反应速率
时段反应速率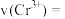
_______  (用代数式表示)。
(用代数式表示)。
 。光照下,草酸(化学式为
。光照下,草酸(化学式为 ,是二元弱酸)能将其中的
,是二元弱酸)能将其中的 转化为
转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾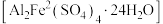 即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在
即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在 下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始
下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始 和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 |  | 30 |
| ③ | 5 |  | 20 | 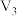 |
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(1)写出草酸与重铬酸钾反应的离子方程式:
(2)

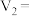
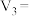
(3)实验①和②的结果表明
(4)实验①中
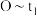 时段反应速率
时段反应速率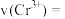
 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
名校
解题方法
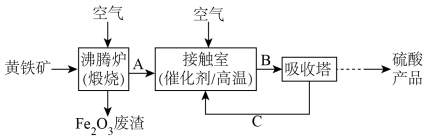
4 . 工业上用黄铁矿 为原料制备硫酸的流程如下:
为原料制备硫酸的流程如下:
回答下列问题:
(1)在接触室中发生的反应是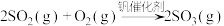 ,该反应属于
,该反应属于_______ (填字母)。
a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(2)沸腾炉中发生反应的化学方程式为_______ 。
(3)利用 废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为
废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为_______ 。
(4)我国 排放标准限值为
排放标准限值为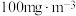 。硫酸工业废气(假设含硫化合物均为
。硫酸工业废气(假设含硫化合物均为 )可采用雾化的氨水与废气直接接触以吸收
)可采用雾化的氨水与废气直接接触以吸收 (反应生成
(反应生成 ),若烟气
),若烟气 含量为
含量为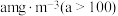 ,试计算每立方米烟气至少需要浓度为
,试计算每立方米烟气至少需要浓度为 氨水
氨水_______ L(用含a、b的代数式表示),才能使该烟气 排放值为
排放值为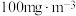 。
。
(5) 可用于杀菌、消毒。葡萄酒里含有微量
可用于杀菌、消毒。葡萄酒里含有微量 ,起保鲜、杀菌和抗氧化作用。氯水和
,起保鲜、杀菌和抗氧化作用。氯水和 都有漂白性,有人为增强漂白效果,将
都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:_______ 。
(6)大气中的水蒸气在紫外线作用下会转化为活泼的 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可看作催化剂,将
可看作催化剂,将 转化为
转化为 ,过程如下:
,过程如下: 。按题目给出的信息,在第二步
。按题目给出的信息,在第二步 与
与 按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式_______ 。
 为原料制备硫酸的流程如下:
为原料制备硫酸的流程如下:
回答下列问题:
(1)在接触室中发生的反应是
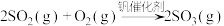 ,该反应属于
,该反应属于a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(2)沸腾炉中发生反应的化学方程式为
(3)利用
 废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为
废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为(4)我国
 排放标准限值为
排放标准限值为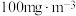 。硫酸工业废气(假设含硫化合物均为
。硫酸工业废气(假设含硫化合物均为 )可采用雾化的氨水与废气直接接触以吸收
)可采用雾化的氨水与废气直接接触以吸收 (反应生成
(反应生成 ),若烟气
),若烟气 含量为
含量为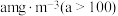 ,试计算每立方米烟气至少需要浓度为
,试计算每立方米烟气至少需要浓度为 氨水
氨水 排放值为
排放值为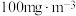 。
。(5)
 可用于杀菌、消毒。葡萄酒里含有微量
可用于杀菌、消毒。葡萄酒里含有微量 ,起保鲜、杀菌和抗氧化作用。氯水和
,起保鲜、杀菌和抗氧化作用。氯水和 都有漂白性,有人为增强漂白效果,将
都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:(6)大气中的水蒸气在紫外线作用下会转化为活泼的
 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可看作催化剂,将
可看作催化剂,将 转化为
转化为 ,过程如下:
,过程如下: 。按题目给出的信息,在第二步
。按题目给出的信息,在第二步 与
与 按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
您最近一年使用:0次
解题方法
5 . 配平氧化还原反应方程式
(1)_____Na + _____H2O=_____NaOH +____ H2___________
(2)_____FeCl3+_____SO2+______H2O=___FeCl2+____H2SO4+____HCl___________
(1)_____Na + _____H2O=_____NaOH +____ H2
(2)_____FeCl3+_____SO2+______H2O=___FeCl2+____H2SO4+____HCl
您最近一年使用:0次
名校
6 . “接触法制硫酸”的主要反应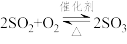 在催化剂表面的反应历程如下:
在催化剂表面的反应历程如下:
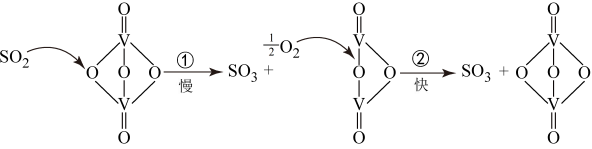
下列说法错误的是
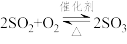 在催化剂表面的反应历程如下:
在催化剂表面的反应历程如下:
下列说法错误的是
| A.使用上述催化剂不能改变该反应的焓变 | B.反应②的活化能比反应①大 |
| C.过程中既有V-O键的断裂,也有V-O键的形成 | D.该反应的催化剂是 |
您最近一年使用:0次
名校
解题方法
7 . 今有10种物质:①Al②氢氧化钠溶液③Na2FeO4④NH3⑤CO2⑥Al2O3⑦石墨⑧Cl2⑨NaHCO3⑩酒精按要求完成下列填空。
(1)以上物质属于电解质___________ (填写相应的编号);
(2)写出②和⑨的溶液反应的离子方程式___________ ;
(3)⑤可以和Na2O2反应,写出该反应的化学方程式___________ 。
(4)⑧可以用于制备“战略金属”钛,其中有关反应如下: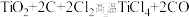 ,该反应中氧化剂是
,该反应中氧化剂是_______ (填化学式)。用双线桥标出反应中电子转移的方向和数目:__________ 。
(5)③称为高铁酸钠,是水处理过程中的一种新型的绿色多功能净水剂。从物质分类的角度,高铁酸钠属于__________ (“酸”、“碱”、“盐”或“氧化物”),高铁酸钠净水过程中发生的化学反应主要是: Na2FeO4+H2O=Fe(OH)3(胶体)+ O2↑+NaOH,请配平该化学方程式___________ 。
(6)0.5molAl2O3的质量为___________ ;3.4gNH3所含分子数为___________ (用NA表示);
(1)以上物质属于电解质
(2)写出②和⑨的溶液反应的离子方程式
(3)⑤可以和Na2O2反应,写出该反应的化学方程式
(4)⑧可以用于制备“战略金属”钛,其中有关反应如下:
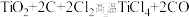 ,该反应中氧化剂是
,该反应中氧化剂是(5)③称为高铁酸钠,是水处理过程中的一种新型的绿色多功能净水剂。从物质分类的角度,高铁酸钠属于
(6)0.5molAl2O3的质量为
您最近一年使用:0次
8 . 辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
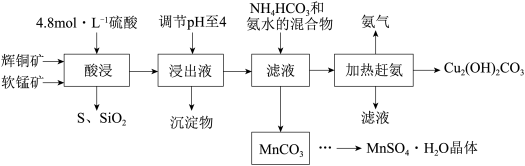
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制240mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要___________ 。
(2)酸浸时,为了提高浸取率可采取的措施有___________ (任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:___________ 。
(4)调节浸出液pH=4的作用是___________ 。
(5)写出流程中生成MnCO3的离子方程式___________ 。
(6)MnCO3先加稀硫酸溶解,在经过___________ 得到MnSO4·H2O晶体
(7)本工艺中可循环使用的物质是___________ (写化学式)。

已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
| 金属离子 | Fe3+ | Mn2+ | Cu2+ |
| 开始沉淀pH值 | 1.5 | 8.3 | 4.4 |
| 完全沉淀pH值 | 3.2 | 9.8 | 6.4 |
(1)实验室配制240mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要
(2)酸浸时,为了提高浸取率可采取的措施有
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:
(4)调节浸出液pH=4的作用是
(5)写出流程中生成MnCO3的离子方程式
(6)MnCO3先加稀硫酸溶解,在经过
(7)本工艺中可循环使用的物质是
您最近一年使用:0次
名校
解题方法
9 . 从砷化镓废料(主要成分为GaAs,含Fe2O3、SiO2和CaCO3等杂质)中回收镓和砷的工艺流程如下:
已知:镓(Ga)既能溶于酸也能溶于碱,与NaOH溶液反应生成NaGaO2和H2。
回答下列问题:
(1)“浆化”是将砷化镓废料转变成悬浊液的过程,其目的是____ 。

(2)砷化镓(GaAs)在“碱浸”时,砷转化为Na3AsO4进入溶液,该反应的化学方程式为____ 。
(3)“碱浸”的温度控制在70℃左右,温度不能过高的原因是___ ;“滤渣II”的成分为___ (填化学式)。
(4)向浸出液中加H2SO4进行“中和”,调节pH使镓和硅共沉淀,不同pH时沉淀率如下表所示。根据表中数据可知,“中和”的pH应调节至____ 范围内,沉淀的效果最好。
(5)“旋流电解”时用惰性电极,则所得“尾液”的溶质主要是____ (填化学式),可进行循环利用,提高经济效益。
(6)若用240kg含镓3%的砷化镓废料回收镓,得到纯度为98%的镓7.20kg,则镓的回收率为___ %(结果保留三位有效数字)。
已知:镓(Ga)既能溶于酸也能溶于碱,与NaOH溶液反应生成NaGaO2和H2。
回答下列问题:
(1)“浆化”是将砷化镓废料转变成悬浊液的过程,其目的是

(2)砷化镓(GaAs)在“碱浸”时,砷转化为Na3AsO4进入溶液,该反应的化学方程式为
(3)“碱浸”的温度控制在70℃左右,温度不能过高的原因是
(4)向浸出液中加H2SO4进行“中和”,调节pH使镓和硅共沉淀,不同pH时沉淀率如下表所示。根据表中数据可知,“中和”的pH应调节至
| pH | 镓沉淀率/% | 硅沉淀率/% | 砷沉淀率/% |
| 4.0 | 75.0 | 89.2 | 0.02 |
| 5.0 | 98.5 | 98.6 | 0.01 |
| 6.0 | 98.9 | 99.2 | 0.02 |
| 7.0 | 95.3 | 99.5 | 0.06 |
| 8.0 | 86.1 | 86.3 | 0.11 |
| 9.0 | 57.4 | 65.1 | 0.13 |
(5)“旋流电解”时用惰性电极,则所得“尾液”的溶质主要是
(6)若用240kg含镓3%的砷化镓废料回收镓,得到纯度为98%的镓7.20kg,则镓的回收率为
您最近一年使用:0次
名校
10 . 某离子反应涉及H+、Bi3+、 、
、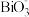 、Mn2+、H2O六种微粒。其中c(
、Mn2+、H2O六种微粒。其中c( )随反应进行逐渐增大。下列判断错误的是
)随反应进行逐渐增大。下列判断错误的是
 、
、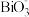 、Mn2+、H2O六种微粒。其中c(
、Mn2+、H2O六种微粒。其中c( )随反应进行逐渐增大。下列判断错误的是
)随反应进行逐渐增大。下列判断错误的是| A.氧化剂与还原剂的物质的量之比为2:5 |
B.氧化性: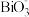 大于 大于 |
| C.反应后溶液的pH值增大 |
| D.若有1mol还原剂参加反应,转移电子的物质的量为5mol |
您最近一年使用:0次



