1 . 实验室探究化合物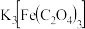 受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。回答下列问题:
受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。回答下列问题:
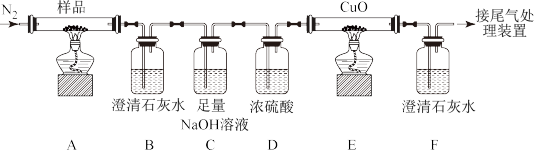
(1)实验开始时,缓缓通入氮气一段时间后,应先加热反应管E,后加热反应管A,原因是_______ 。
(2)待反应完全后,停止加热,仍持续不断地通入氮气,直至反应管冷却到室温。停止加热时,不需要先断开A、B的连接处和E、F的连接处,原因是_______ 。
(3)足量NaOH溶液的作用是_______ 。NaOH的电子式为_______ 。
(4)能证明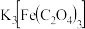 分解产物中有CO气体生成的实验现象是
分解产物中有CO气体生成的实验现象是_______ 。
(5)充分反应后,A中所得黑色粉末经检测为Fe和FeO的混合物。取该黑色粉末4.4g,溶于过量稀硝酸中,收集到标准状况下NO气体1.12L。该黑色粉末中,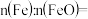
_______ 。
(6) 和
和 、
、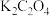 反应可制得
反应可制得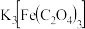 。已知常温下
。已知常温下 和
和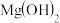 的Ksp分别为
的Ksp分别为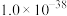 、
、 。常温下浓度均为
。常温下浓度均为 的
的 、
、 的混合溶液中,要使
的混合溶液中,要使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 时,即可认为该离子已沉淀完全)而
时,即可认为该离子已沉淀完全)而 不沉淀,应该调节溶液的pH的范围为
不沉淀,应该调节溶液的pH的范围为_______ 。
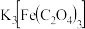 受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。回答下列问题:
受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。回答下列问题:
(1)实验开始时,缓缓通入氮气一段时间后,应先加热反应管E,后加热反应管A,原因是
(2)待反应完全后,停止加热,仍持续不断地通入氮气,直至反应管冷却到室温。停止加热时,不需要先断开A、B的连接处和E、F的连接处,原因是
(3)足量NaOH溶液的作用是
(4)能证明
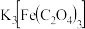 分解产物中有CO气体生成的实验现象是
分解产物中有CO气体生成的实验现象是(5)充分反应后,A中所得黑色粉末经检测为Fe和FeO的混合物。取该黑色粉末4.4g,溶于过量稀硝酸中,收集到标准状况下NO气体1.12L。该黑色粉末中,
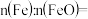
(6)
 和
和 、
、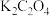 反应可制得
反应可制得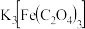 。已知常温下
。已知常温下 和
和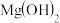 的Ksp分别为
的Ksp分别为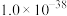 、
、 。常温下浓度均为
。常温下浓度均为 的
的 、
、 的混合溶液中,要使
的混合溶液中,要使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 时,即可认为该离子已沉淀完全)而
时,即可认为该离子已沉淀完全)而 不沉淀,应该调节溶液的pH的范围为
不沉淀,应该调节溶液的pH的范围为
您最近一年使用:0次
2022-08-08更新
|
180次组卷
|
2卷引用:河北省普通高中2023届高二学业水平选择性考试(一)化学试题
2 . 高纯超细氧化铝粉是一种新型无机功能材料,以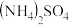 和
和 为原料制备复盐硫酸铝铵晶体[
为原料制备复盐硫酸铝铵晶体[ ],将硫酸铝铵晶体热分解可制得高纯超细氧化铝粉,其流程如下:
],将硫酸铝铵晶体热分解可制得高纯超细氧化铝粉,其流程如下:

回答下列问题:
(1)操作①需加入适量稀硫酸,其目的是_______ ,采用的纯化方法为_______ 。
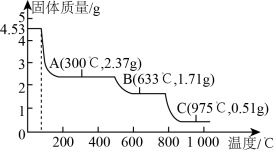
(2)取 加热分解,加热过程中固体质量随温度的变化如图所示。硫酸铝铵晶体在633℃、975℃分解生成的固体分别为
加热分解,加热过程中固体质量随温度的变化如图所示。硫酸铝铵晶体在633℃、975℃分解生成的固体分别为_______ 、_______ 。(填化学式)
(3)实验室以 和
和 为原料,在一定条件下反应生成制备纳米
为原料,在一定条件下反应生成制备纳米 的前驱体
的前驱体 沉淀,同时生成
沉淀,同时生成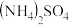 、
、 和
和 。
。 高温分解即得超细氧化铝粉。反应生成
高温分解即得超细氧化铝粉。反应生成 沉淀的化学方程式为
沉淀的化学方程式为_______ 。
(4)为了测定高纯超细氧化铝粉中 的质量分数,可用EDTA标准溶液滴定。取0.2035g高纯超细氧化铝粉溶于盐酸,加入过量的30.00mL0.1600
的质量分数,可用EDTA标准溶液滴定。取0.2035g高纯超细氧化铝粉溶于盐酸,加入过量的30.00mL0.1600 EDTA标准溶液并加热煮沸,充分反应后,再用
EDTA标准溶液并加热煮沸,充分反应后,再用 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液。已知
标准溶液。已知 、
、 与EDTA反应的化学计量数之比均为1:1。
与EDTA反应的化学计量数之比均为1:1。
①加入过量的EDTA标准溶液并加热煮沸,其原因是_______ 。
②高纯超细氧化铝粉中, 的质量分数为
的质量分数为_______ %(保留1位小数)。
 和
和 为原料制备复盐硫酸铝铵晶体[
为原料制备复盐硫酸铝铵晶体[ ],将硫酸铝铵晶体热分解可制得高纯超细氧化铝粉,其流程如下:
],将硫酸铝铵晶体热分解可制得高纯超细氧化铝粉,其流程如下:
回答下列问题:
(1)操作①需加入适量稀硫酸,其目的是
(2)取
 加热分解,加热过程中固体质量随温度的变化如图所示。硫酸铝铵晶体在633℃、975℃分解生成的固体分别为
加热分解,加热过程中固体质量随温度的变化如图所示。硫酸铝铵晶体在633℃、975℃分解生成的固体分别为
(3)实验室以
 和
和 为原料,在一定条件下反应生成制备纳米
为原料,在一定条件下反应生成制备纳米 的前驱体
的前驱体 沉淀,同时生成
沉淀,同时生成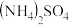 、
、 和
和 。
。 高温分解即得超细氧化铝粉。反应生成
高温分解即得超细氧化铝粉。反应生成 沉淀的化学方程式为
沉淀的化学方程式为(4)为了测定高纯超细氧化铝粉中
 的质量分数,可用EDTA标准溶液滴定。取0.2035g高纯超细氧化铝粉溶于盐酸,加入过量的30.00mL0.1600
的质量分数,可用EDTA标准溶液滴定。取0.2035g高纯超细氧化铝粉溶于盐酸,加入过量的30.00mL0.1600 EDTA标准溶液并加热煮沸,充分反应后,再用
EDTA标准溶液并加热煮沸,充分反应后,再用 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液。已知
标准溶液。已知 、
、 与EDTA反应的化学计量数之比均为1:1。
与EDTA反应的化学计量数之比均为1:1。①加入过量的EDTA标准溶液并加热煮沸,其原因是
②高纯超细氧化铝粉中,
 的质量分数为
的质量分数为
您最近一年使用:0次
2022-08-08更新
|
238次组卷
|
2卷引用:河北省普通高中2023届高二学业水平选择性考试(一)化学试题
3 . 镍行业发展蕴藏着巨大的潜力。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下:

已知:①Ksp(CaF2)=1.6×10-10、Ksp[Fe(OH)2]=8.0×10-16、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=2.7×10-34;
②认为残留在溶液中的离子浓度小于1×10-5mol/L即沉淀完全。
(1)“粉碎”的目的是___________ 。滤渣Ⅰ的成分有___________ (化学式)。
(2)在“调pH”过程中,应先加入H2O2,发生反应的离子方程式为___________ ,沉淀剂可选择___________ 。(填序号)
a.NiOb.NaOHc.Ni(OH)2d.NiCO3
为将Al3+、Fe3+沉淀完全,至少应调节pH到___________ (已知lg3≈0.5)。
(3)在“沉淀”过程中,Ca2+刚好沉淀完全时,溶液中c(F-)=___________ mol/L。
(4)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍,且还生成一种气体,请写出该制备过程的化学方程式:___________ 。

已知:①Ksp(CaF2)=1.6×10-10、Ksp[Fe(OH)2]=8.0×10-16、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=2.7×10-34;
②认为残留在溶液中的离子浓度小于1×10-5mol/L即沉淀完全。
(1)“粉碎”的目的是
(2)在“调pH”过程中,应先加入H2O2,发生反应的离子方程式为
a.NiOb.NaOHc.Ni(OH)2d.NiCO3
为将Al3+、Fe3+沉淀完全,至少应调节pH到
(3)在“沉淀”过程中,Ca2+刚好沉淀完全时,溶液中c(F-)=
(4)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍,且还生成一种气体,请写出该制备过程的化学方程式:
您最近一年使用:0次
2021-02-08更新
|
345次组卷
|
3卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)



