镍行业发展蕴藏着巨大的潜力。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下:

已知:①Ksp(CaF2)=1.6×10-10、Ksp[Fe(OH)2]=8.0×10-16、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=2.7×10-34;
②认为残留在溶液中的离子浓度小于1×10-5mol/L即沉淀完全。
(1)“粉碎”的目的是___________ 。滤渣Ⅰ的成分有___________ (化学式)。
(2)在“调pH”过程中,应先加入H2O2,发生反应的离子方程式为___________ ,沉淀剂可选择___________ 。(填序号)
a.NiOb.NaOHc.Ni(OH)2d.NiCO3
为将Al3+、Fe3+沉淀完全,至少应调节pH到___________ (已知lg3≈0.5)。
(3)在“沉淀”过程中,Ca2+刚好沉淀完全时,溶液中c(F-)=___________ mol/L。
(4)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍,且还生成一种气体,请写出该制备过程的化学方程式:___________ 。

已知:①Ksp(CaF2)=1.6×10-10、Ksp[Fe(OH)2]=8.0×10-16、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=2.7×10-34;
②认为残留在溶液中的离子浓度小于1×10-5mol/L即沉淀完全。
(1)“粉碎”的目的是
(2)在“调pH”过程中,应先加入H2O2,发生反应的离子方程式为
a.NiOb.NaOHc.Ni(OH)2d.NiCO3
为将Al3+、Fe3+沉淀完全,至少应调节pH到
(3)在“沉淀”过程中,Ca2+刚好沉淀完全时,溶液中c(F-)=
(4)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍,且还生成一种气体,请写出该制备过程的化学方程式:
更新时间:2021-02-08 21:21:33
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H1= - Q kJ·mol-1。若标准状况下产生112LSO2(g),则该反应放出热量为______________ 。(用Q表示)
(2)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
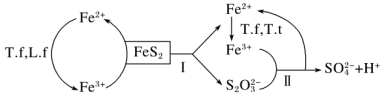
已知:脱硫总反应为:FeS2+14Fe3++8H2O=SO +15Fe2++16H+,
+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O=S2O +7Fe2++6H+;
+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____________ 。
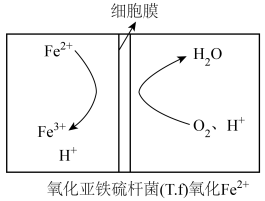
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为图所示的原电池: 该细胞膜为________ (填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为___________ 。该方法在高温下脱硫效率大大降低,原因是_______ 。
(1)已知:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H1= - Q kJ·mol-1。若标准状况下产生112LSO2(g),则该反应放出热量为
(2)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:

已知:脱硫总反应为:FeS2+14Fe3++8H2O=SO
 +15Fe2++16H+,
+15Fe2++16H+,Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O=S2O
 +7Fe2++6H+;
+7Fe2++6H+;写出Ⅱ反应的化学方程式
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为图所示的原电池: 该细胞膜为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领域应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:
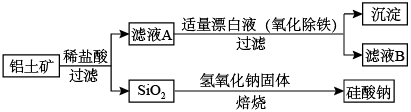
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___ Fe2++___ ClO-+___ =___ Fe(OH)3↓+___ C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___ (选填代号)
A.氢氧化钠溶液B.硫酸溶液C.氨水D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___ (填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)2•12H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___ ;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___ 。
(2)实验证明铵明矾高温分解后气体的组成成分是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___ 。
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___ (填代号)。

Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
A.氢氧化钠溶液B.硫酸溶液C.氨水D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、
Ⅱ.铵明矾(NH4Al(SO4)2•12H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理
(2)实验证明铵明矾高温分解后气体的组成成分是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】2022年6月5日,搭载神舟十四号载人飞船的火箭成功发射。钛合金材料用于制造航天器的燃料储箱、火箭发动机壳体和喷嘴导管、自夹持螺栓紧固件等。用钛铁矿渣(主要成分为 、FeO、
、FeO、 等)作原料,生产二氧化钛的主要步骤如下:
等)作原料,生产二氧化钛的主要步骤如下:

请按要求回答下列问题:
(1)Ti位于元素周期表中第_______ 族,基态时原子核外电子排布式为[Ar]_______ 。
(2)实际生产时,向沸水中加入滤液III,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请依据平衡原理分析通入高温水蒸气的作用:_______ 。
(3)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、 、
、_______ 、_______ (填化学式),减少废弃物排放。
(4)得到的水合二氧化钛即使用水充分洗涤,煅烧后获得的二氧化钛(白色)也会发黄,发黄的杂质是_______ (填化学式)。
(5)工业上,常采用“加碳氯化”的方法以 为原料生产
为原料生产 ,相应的化学方程式为:
,相应的化学方程式为:
I.
 ,
,
II.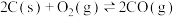
 ,
,
结合数据说明氯化过程中加碳的理由_______ 。
(6)请写出工业上“镁法”高温还原 制钛的化学方程式
制钛的化学方程式_______ 。
 、FeO、
、FeO、 等)作原料,生产二氧化钛的主要步骤如下:
等)作原料,生产二氧化钛的主要步骤如下:
请按要求回答下列问题:
(1)Ti位于元素周期表中第
(2)实际生产时,向沸水中加入滤液III,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请依据平衡原理分析通入高温水蒸气的作用:
(3)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、
 、
、(4)得到的水合二氧化钛即使用水充分洗涤,煅烧后获得的二氧化钛(白色)也会发黄,发黄的杂质是
(5)工业上,常采用“加碳氯化”的方法以
 为原料生产
为原料生产 ,相应的化学方程式为:
,相应的化学方程式为:I.

 ,
,
II.
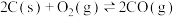
 ,
,
结合数据说明氯化过程中加碳的理由
(6)请写出工业上“镁法”高温还原
 制钛的化学方程式
制钛的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

(1)向滤液Ⅰ中加入FeS固体是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Zn2+的离子方程式为_________________________ 。
(2)根据对滤液Ⅱ的操作作答:
①在40℃左右向滤液Ⅱ中加入6%的H2O2,温度不能过高的原因是:_________ ;用离子方程式表示H2O2的作用_________________ ②调滤液ⅡpH的目的是_____________ 。
③检验Fe3+是否除尽的操作和现象是_________________________________ 。
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______________________ 。
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4·6H2O晶体。
①在进行蒸发浓缩操作时,加热到_________ (描述实验现象)时,则停止加热。
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的___ (填“a”、“b”、“c”或“d”)位置。
③如果得到产品的纯度不够,则应该进行_________ 操作。(填序号)
A.蒸馏 B.分液 C.重结晶 D.过滤

(1)向滤液Ⅰ中加入FeS固体是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Zn2+的离子方程式为
(2)根据对滤液Ⅱ的操作作答:
①在40℃左右向滤液Ⅱ中加入6%的H2O2,温度不能过高的原因是:
③检验Fe3+是否除尽的操作和现象是
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4·6H2O晶体。
①在进行蒸发浓缩操作时,加热到
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的
③如果得到产品的纯度不够,则应该进行
A.蒸馏 B.分液 C.重结晶 D.过滤
您最近一年使用:0次
【推荐2】(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好采用的是_________ (填下面的选项),加入该氧化剂时,温度不能太高,原因是_________ 。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有_________ 。
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?_________ (FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24)
(2)常温下Ksp[Fe(OH)3]=8.0×10−38,Ksp[Cu(OH)2]=3.0×10−20,通常认为残留在溶液中的离子浓度小于1×10−5mol⋅L−1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol⋅L−1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为_________ 。(已知lg5=0.7)。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:_________ 。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?
(2)常温下Ksp[Fe(OH)3]=8.0×10−38,Ksp[Cu(OH)2]=3.0×10−20,通常认为残留在溶液中的离子浓度小于1×10−5mol⋅L−1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol⋅L−1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:
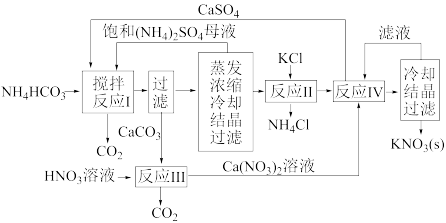
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为________________ 。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是_________________ 。从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是______________________________ 。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,____________ 。
(4)整个循环流程中,需不断补充的原料除NH4HCO3外,还有____________ (填化学式)。

(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,
(4)整个循环流程中,需不断补充的原料除NH4HCO3外,还有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】ZnO有优异的常温发光性能,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。工业上利用锌焙砂(主要成分为ZnO、ZnFe2O4,还含有Fe3O4、Al2O3、SiO2等)制取氧化锌的工艺流程如图所示:
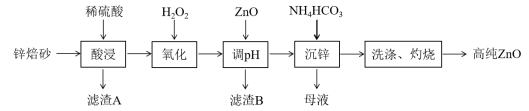
已知:相关金属离子c(Mn+)=0.1 mol·L-1生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)ZnFe2O4可写出ZnO·Fe2O3,则ZnFe2O4与H2SO4反应的化学方程式___________ ;“酸浸”时为了提高浸取速率,可以采取的措施是___________ (任写一种)。
(2)“氧化”步骤中发生的离子方程式为___________ ,H2O2的实际用量比理论用量要大,原因是___________ 。
(3)滤渣B的主要成分为___________ ;加ZnO时,为了不生成Zn(OH)2,该步骤需要控制溶液pH的范围是___________ ;若室温下将溶液的pH调为4,则此时Fe3+的浓度为___________ (已知Ksp[Fe(OH)3]=4×10−38)。
(4)“沉锌”反应中,往滤液加入NH4HCO3溶液,生成ZnCO3·Zn(OH)2及CO2,写出相应的离子方程式___________ 。“沉锌”后的母液可进一步处理,获得一种化工原料,写出该原料在生产中的一种用途___________ 。

已知:相关金属离子c(Mn+)=0.1 mol·L-1生成氢氧化物沉淀的pH如下表所示:
| Fe2+ | Fe3+ | Al3+ | Zn2+ | |
| 开始沉淀 | 6.5 | 2.7 | 3.4 | 6.5 |
| 沉淀完全 | 9.7 | 3.7 | 4.7 | 8.5 |
(1)ZnFe2O4可写出ZnO·Fe2O3,则ZnFe2O4与H2SO4反应的化学方程式
(2)“氧化”步骤中发生的离子方程式为
(3)滤渣B的主要成分为
(4)“沉锌”反应中,往滤液加入NH4HCO3溶液,生成ZnCO3·Zn(OH)2及CO2,写出相应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】 在电池中有重要应用。以主要成分为
在电池中有重要应用。以主要成分为 的软锰矿(含有铁、铝、硅的氧化物)为原料制备粗二氧化锰颗粒的过程如下:
的软锰矿(含有铁、铝、硅的氧化物)为原料制备粗二氧化锰颗粒的过程如下:

常温下一些氢氧化物沉淀时的
(1)为提高还原阶段 的利用率,生产过程中可采取的措施有
的利用率,生产过程中可采取的措施有_______ (写一条即可),还原过程中还原产物是 ,写出对应的离子方程式
,写出对应的离子方程式_______ ,有人认为可利用硫酸工厂的烟气代替 ,你的观点是
,你的观点是_______ 。
(2)制备过程中进行氧化操作的目的是_______ ,相应的试剂可以是空气、 、
、 、硝酸等,从控制生产成本角度看,你选用的试剂是
、硝酸等,从控制生产成本角度看,你选用的试剂是_______ (用对应的离子方程式体现出来)。
(3)加入氨水时溶液 的调控范围是
的调控范围是_______ ,若溶液中离子浓度不大于 时表明该离子沉淀完全,则当溶液
时表明该离子沉淀完全,则当溶液 时,溶液中
时,溶液中
_______ 。
(4)沉锰时得到的沉淀是 ,则热解时氧化剂与还原剂的物质的量之比为
,则热解时氧化剂与还原剂的物质的量之比为_______ 。
 在电池中有重要应用。以主要成分为
在电池中有重要应用。以主要成分为 的软锰矿(含有铁、铝、硅的氧化物)为原料制备粗二氧化锰颗粒的过程如下:
的软锰矿(含有铁、铝、硅的氧化物)为原料制备粗二氧化锰颗粒的过程如下:
常温下一些氢氧化物沉淀时的

| 金属氢氧化物 |  |  |  | 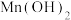 |
开始沉淀时的 | 2.3 | 6.8 | 3.6 | 8.1 |
完全沉淀时的 | 3.2 | 8.7 | 5.2 | 9.8 |
 的利用率,生产过程中可采取的措施有
的利用率,生产过程中可采取的措施有 ,写出对应的离子方程式
,写出对应的离子方程式 ,你的观点是
,你的观点是(2)制备过程中进行氧化操作的目的是
 、
、 、硝酸等,从控制生产成本角度看,你选用的试剂是
、硝酸等,从控制生产成本角度看,你选用的试剂是(3)加入氨水时溶液
 的调控范围是
的调控范围是 时表明该离子沉淀完全,则当溶液
时表明该离子沉淀完全,则当溶液 时,溶液中
时,溶液中
(4)沉锰时得到的沉淀是
 ,则热解时氧化剂与还原剂的物质的量之比为
,则热解时氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】三氧化二镍 是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取
是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取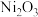 ,工业流程如图:
,工业流程如图:

已知:①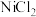 易溶于水,
易溶于水, 不能氧化
不能氧化
②已知实验温度时的溶解度:
③ ,
,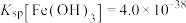 ,
, ,
, 。
。
回答下列问题:
(1)“预处理”操作可以选择用___________ (填标号)来除去废旧镍电池表面的矿物油污。
A.纯碱溶液浸泡B.NaOH溶液浸泡
C.酒精清洗D.硫酸溶液浸泡
(2)酸浸时镍的浸出率与温度的关系如图1所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是___________ 。
常温下,盐酸的浓度为2.5mol/L,液固比与镍的浸出率的关系如表所示:
实际生产采取的液固比为___________ ,主要原因是___________ 。
(3)滤渣2的主要成分是___________ ,室温下要使杂质离子沉淀完全,溶液的pH最小为___________  。
。
(4)在实验温度下,沉镍步骤析出的固体物质化学式是___________ ,准确称取该固体样品m g在氩气中加热,分解过程经历了两个阶段,样品中固体残留的质量与温度的变化如图2所示,试写出325~450℃时分解的化学方程式___________ 。

 是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取
是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取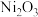 ,工业流程如图:
,工业流程如图:
已知:①
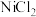 易溶于水,
易溶于水, 不能氧化
不能氧化
②已知实验温度时的溶解度:

③
 ,
,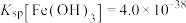 ,
, ,
, 。
。回答下列问题:
(1)“预处理”操作可以选择用
A.纯碱溶液浸泡B.NaOH溶液浸泡
C.酒精清洗D.硫酸溶液浸泡
(2)酸浸时镍的浸出率与温度的关系如图1所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是
常温下,盐酸的浓度为2.5mol/L,液固比与镍的浸出率的关系如表所示:
| 液固比 | 7∶1 | 6∶1 | 5∶1 |
| 镍的浸出率/% | 95.63 | 95.32 | 89.68 |
实际生产采取的液固比为
(3)滤渣2的主要成分是
 。
。(4)在实验温度下,沉镍步骤析出的固体物质化学式是

您最近一年使用:0次



