铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领域应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:
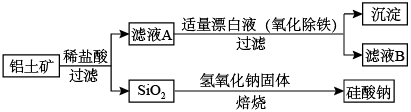
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___ Fe2++___ ClO-+___ =___ Fe(OH)3↓+___ C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___ (选填代号)
A.氢氧化钠溶液B.硫酸溶液C.氨水D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___ (填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)2•12H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___ ;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___ 。
(2)实验证明铵明矾高温分解后气体的组成成分是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___ 。
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___ (填代号)。

Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
A.氢氧化钠溶液B.硫酸溶液C.氨水D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、
Ⅱ.铵明矾(NH4Al(SO4)2•12H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理
(2)实验证明铵明矾高温分解后气体的组成成分是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为

更新时间:2020-07-11 18:43:18
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】钛酸钡具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。工业上以BaCO3、TiCl4为原料,采用草酸盐共沉淀法制备草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再高温煅烧得到钛酸钡粉末,其制备工艺流程如图所示:

(1)草酸中碳元素的化合价为__________ ,“煅烧”步骤中得到BaTiO3、CO、H2O及气体产物X,X的电子式为__________ 。
(2)钛元素在不同pH下,以TiO(OH)2、TiOC2O4、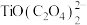 等形式存在,如图所示,“混合”操作中,先用氨水调节混合溶液的pH在2.5~3之间,再进行“沉淀”。图中曲线b、c分别对应钛的形式为
等形式存在,如图所示,“混合”操作中,先用氨水调节混合溶液的pH在2.5~3之间,再进行“沉淀”。图中曲线b、c分别对应钛的形式为__________ 、__________ 。

(3)“酸溶”时发生反应的离子方程式为____________________ 。
(4)写出混合溶液与酸溶液共“沉淀”步骤中发生反应的化学方程式_____________ ;“滤液”的主要成分是_________ (填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净______________ 。
(5)将TiCl4水解产物加热脱水生成TiO2,已知常温下Ti(OH)4的Ksp=7.94×10−54,测得TiCl4水解后溶液的pH=2,此时溶液中c(Ti4+)=__________ 。
(6)制备草酸氧钛钡晶体时要求所用H2C2O4的浓度为0.30 mol·L−1,可用酸性KMnO4溶液测定H2C2O4浓度,其反应为:KMnO4+H2C2O4+H2SO4—K2SO4+MnSO4+CO2↑+H2O(未配平)。现用浓度为0.1 mol·L−1酸性KMnO4溶液滴定未知浓度的H2C2O4,记录数据如下:
则该H2C2O4溶液是否可用于制备草酸氧钛钡晶体_________ (填“是”或“否”)。

(1)草酸中碳元素的化合价为
(2)钛元素在不同pH下,以TiO(OH)2、TiOC2O4、
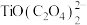 等形式存在,如图所示,“混合”操作中,先用氨水调节混合溶液的pH在2.5~3之间,再进行“沉淀”。图中曲线b、c分别对应钛的形式为
等形式存在,如图所示,“混合”操作中,先用氨水调节混合溶液的pH在2.5~3之间,再进行“沉淀”。图中曲线b、c分别对应钛的形式为
(3)“酸溶”时发生反应的离子方程式为
(4)写出混合溶液与酸溶液共“沉淀”步骤中发生反应的化学方程式
(5)将TiCl4水解产物加热脱水生成TiO2,已知常温下Ti(OH)4的Ksp=7.94×10−54,测得TiCl4水解后溶液的pH=2,此时溶液中c(Ti4+)=
(6)制备草酸氧钛钡晶体时要求所用H2C2O4的浓度为0.30 mol·L−1,可用酸性KMnO4溶液测定H2C2O4浓度,其反应为:KMnO4+H2C2O4+H2SO4—K2SO4+MnSO4+CO2↑+H2O(未配平)。现用浓度为0.1 mol·L−1酸性KMnO4溶液滴定未知浓度的H2C2O4,记录数据如下:
| 滴定次数 | 待测溶液体积/mL | KMnO4溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上利用绿矾制备还原铁粉的工业流程如下:
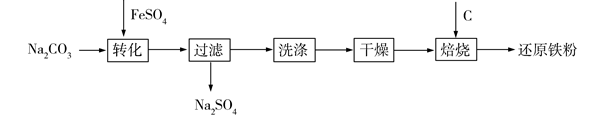
(1)制备FeCO3时,选用的加料方式是_______________ (填字母)。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________ 。
(3)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为________________ 。
(4)取干燥后的FeCO3样品12.49 g隔绝空气焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为_______________ (写出一种即可),计算FeCO3样品中FeCO3与FeOOH的质量_____________ (写出计算过程)。

(1)制备FeCO3时,选用的加料方式是
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
(3)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为
(4)取干燥后的FeCO3样品12.49 g隔绝空气焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】工业生产中会产生稀土草酸沉淀废水,其主要成分为盐酸和草酸(H2C2O4)的混合溶液及微量的草酸稀土杂质等。工业上处理废水的方法包括“①氧化法”和“②沉淀法”。相关工业流程如图所示:
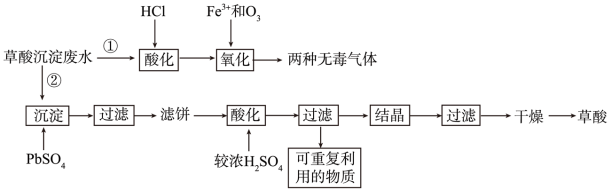
已知:(1)Ka1(H2C2O4)=6.0×10-2;Ka2(H2C2O4)=6.25×10-5。
(2)25℃时,各物质的溶度积常数如表:
回答下列问题:
(1)过滤操作中需要用到的玻璃仪器有___ ,上述过滤后可重复利用的物质为___ (填物质名称)。
(2)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体,该氧化过程中的化学方程式为___ 。
(3)“氧化”步骤中,酸性越强,草酸去除率越高,其原因是___ 。为了使加入的17.5mg·L-1的Fe3+催化效果达到最佳,废水酸化时应将pH调整至小于___ (已知lg2=0.3,1g5=0.7)。
(4)“②沉淀法”:将1.5molPbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+SO
PbC2O4(s)+2H+(aq)+SO (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=___ 。
(5)干燥步骤温度过高会降低草酸产率,其原因是___ 。
(6)已知在25℃时,亚硫酸的电离平衡常数为:K1=1.54×10-2、K2=1.02×10-7,向Na2C2O4溶液中通入少量的SO2气体,反应的离子方程式为___ 。

已知:(1)Ka1(H2C2O4)=6.0×10-2;Ka2(H2C2O4)=6.25×10-5。
(2)25℃时,各物质的溶度积常数如表:
| Ksp[Fe(OH)3] | Ksp(PbSO4) | Ksp(PbC2O4) |
| 2.5×10-39 | 2.0×10-8 | 5.0×10-10 |
回答下列问题:
(1)过滤操作中需要用到的玻璃仪器有
(2)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体,该氧化过程中的化学方程式为
(3)“氧化”步骤中,酸性越强,草酸去除率越高,其原因是
(4)“②沉淀法”:将1.5molPbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)
 PbC2O4(s)+2H+(aq)+SO
PbC2O4(s)+2H+(aq)+SO (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=(5)干燥步骤温度过高会降低草酸产率,其原因是
(6)已知在25℃时,亚硫酸的电离平衡常数为:K1=1.54×10-2、K2=1.02×10-7,向Na2C2O4溶液中通入少量的SO2气体,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝两种工艺流程如下:

请回答下列问题:
(1)流程乙加入烧碱后的离子方程式为________________________________ 。
(2)固体A的应用____________________________ (两点)。
(3)滤液D与少量CO2反应的离子方程式为___________________________ 。
向该滤液K中加入足量石灰水的离子方程式为__________________________ 。
(4)流程乙制氧化铝的优点是所用的试剂较经济,缺点是_______________ 。

请回答下列问题:
(1)流程乙加入烧碱后的离子方程式为
(2)固体A的应用
(3)滤液D与少量CO2反应的离子方程式为
向该滤液K中加入足量石灰水的离子方程式为
(4)流程乙制氧化铝的优点是所用的试剂较经济,缺点是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】Ⅰ. 和石英砂(
和石英砂( )在工业上用途广泛,为探究它们的性质,设计如图装置进行实验(省略尾气处理装置)。
)在工业上用途广泛,为探究它们的性质,设计如图装置进行实验(省略尾气处理装置)。_______ 。
(2)若要实现硫元素由 价转化为0价,需在C中加入
价转化为0价,需在C中加入_______ 溶液,可观察到淡黄色沉淀产生。此过程体现了 的
的_______ 性。
Ⅱ.“中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为 )制取高纯硅涉及的主要反应用流程图表示如图:
)制取高纯硅涉及的主要反应用流程图表示如图:
Ⅲ.习主席在2020年新年贺词中强调“5G商用加速推出,凝结着新时代奋斗者的心血和汗水,彰显了不同凡响的中国风采、中国力量”,制造芯片用到高纯硅,上述反应③的模拟装置如图所示(热源及夹持装置略去)。已知: 遇水
遇水 强烈水解,沸点较低,在空气中易自燃。
强烈水解,沸点较低,在空气中易自燃。_______ ;
(5)装置C中的烧瓶需要加热,其目的是_______ ;
(6)用 和NaOH固体焙烧制备硅酸钠,可采用图中的装置_______(填选项编号)。
和NaOH固体焙烧制备硅酸钠,可采用图中的装置_______(填选项编号)。
 和石英砂(
和石英砂( )在工业上用途广泛,为探究它们的性质,设计如图装置进行实验(省略尾气处理装置)。
)在工业上用途广泛,为探究它们的性质,设计如图装置进行实验(省略尾气处理装置)。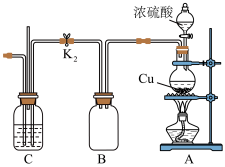
(2)若要实现硫元素由
 价转化为0价,需在C中加入
价转化为0价,需在C中加入 的
的Ⅱ.“中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为
 )制取高纯硅涉及的主要反应用流程图表示如图:
)制取高纯硅涉及的主要反应用流程图表示如图:
| A.反应①中Si是氧化产物 | B.流程中HCl和 可以循环利用 可以循环利用 |
| C.反应①②③均为氧化还原反应 | D. 是两性氧化物 是两性氧化物 |
Ⅲ.习主席在2020年新年贺词中强调“5G商用加速推出,凝结着新时代奋斗者的心血和汗水,彰显了不同凡响的中国风采、中国力量”,制造芯片用到高纯硅,上述反应③的模拟装置如图所示(热源及夹持装置略去)。已知:
 遇水
遇水 强烈水解,沸点较低,在空气中易自燃。
强烈水解,沸点较低,在空气中易自燃。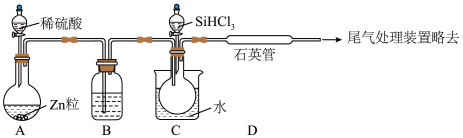
(5)装置C中的烧瓶需要加热,其目的是
(6)用
 和NaOH固体焙烧制备硅酸钠,可采用图中的装置_______(填选项编号)。
和NaOH固体焙烧制备硅酸钠,可采用图中的装置_______(填选项编号)。A. | B. | C. | D. |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】常见物质之间的转化如下图所示:
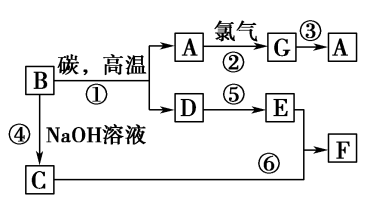
其中B常被用于制造光导纤维,其对应的单质的结构与金刚石的结构是相似的;C、F均含有A物质所含元素;反应中生成的水及次要产物均已略去。
(1)试推测:A________ ,C________ ,F________ 。(写化学式)
(2)试写出反应⑥的离子方程式:_________________________ 。
(3)在反应①中,碳的作用是____________________ ,当生成1 mol A时,转移电子的物质的量为________ 。

其中B常被用于制造光导纤维,其对应的单质的结构与金刚石的结构是相似的;C、F均含有A物质所含元素;反应中生成的水及次要产物均已略去。
(1)试推测:A
(2)试写出反应⑥的离子方程式:
(3)在反应①中,碳的作用是
您最近一年使用:0次
【推荐1】工业上用铝土矿(主要成分是Al2O3以及少量Fe2O3、SiO2等),提取纯Al2O3作冶炼铝的原料。提取流程如图表示:

(1)操作I的名称是____ ,此操作所需要的主要玻璃仪器除了漏斗、烧杯外还有____ 。
(2)写出溶液A中加入过量NaOH溶液生成溶液B的离子方程式:____ ;滤渣B的主要成分是____ (填化学式)。
(3)写出溶液B中通入过量CO2产生沉淀的化学方程式:____ ;该步骤中____ (填“能”或“不能”)改用盐酸代替通入CO2,原因是____ 。
(4)若提取的过程中省略了操作I,将对所得的最后产品(Al2O3)产生的影响是_____ 。

(1)操作I的名称是
(2)写出溶液A中加入过量NaOH溶液生成溶液B的离子方程式:
(3)写出溶液B中通入过量CO2产生沉淀的化学方程式:
(4)若提取的过程中省略了操作I,将对所得的最后产品(Al2O3)产生的影响是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式:__________ 。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式:____________________________________ 。
(2)“转化”时加入NaOH的主要作用是________________________ (用离子方程式表示)。
(3)上述工艺中可以循环利用的主要物质是________________ 、_________________ 和水。

(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式:
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式:
(2)“转化”时加入NaOH的主要作用是
(3)上述工艺中可以循环利用的主要物质是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上以铝土矿(主要成分为Al2O3,含少量Fe2O3、FeO、SiO2等杂质)为主要原料制备氧化铝,流程如下。
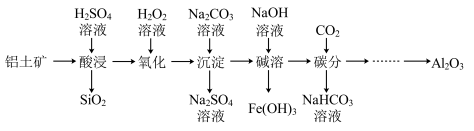
(1)酸浸:用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是_______ 。
(2)氧化:用 溶液将
溶液将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。

①为获得较高的铝、铁沉淀率,应控制溶液pH为_______ 。
②检验Fe3+沉淀完全的操作为_______ 。
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3.下列措施中能提高单位时间内铝元素浸出率的有_______ (填序号)。
A.适当增大NaOH溶液浓度 B.适当加快搅拌速率 C.适当降低温度
(5)碳分:向“碱溶”后的溶液中通入足量 气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为_______ 。

(1)酸浸:用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是
(2)氧化:用
 溶液将
溶液将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。

①为获得较高的铝、铁沉淀率,应控制溶液pH为
②检验Fe3+沉淀完全的操作为
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3.下列措施中能提高单位时间内铝元素浸出率的有
A.适当增大NaOH溶液浓度 B.适当加快搅拌速率 C.适当降低温度
(5)碳分:向“碱溶”后的溶液中通入足量
 气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】已知NH4HCO3 NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
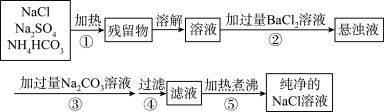
(1)操作④中所需的玻璃仪器有_________________________________ 。
(2)操作②为什么不用硝酸钡溶液,其理由是________________________________ 。
(3)进行操作②后,如何判断SO 已除尽,方法是
已除尽,方法是___________________________ 。
(4)操作③的目的是__________ ,其相应的离子方程式为:____________________ 。
(5)说明此设计方案不严密之处____________________________________________ 。
 NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
(1)操作④中所需的玻璃仪器有
(2)操作②为什么不用硝酸钡溶液,其理由是
(3)进行操作②后,如何判断SO
 已除尽,方法是
已除尽,方法是(4)操作③的目的是
(5)说明此设计方案不严密之处
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用__________ 。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
________________________________________________________________ 。
(3)试剂②可以选用________ ,其反应的离子方程式为______________________ 。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式______________________________________________ 。
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为____ mg·L-1,若某工厂每天生产1.00 t镁,则每天需要海水的体积为________ L。

(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
(3)试剂②可以选用
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4•7H2O),流程如图:
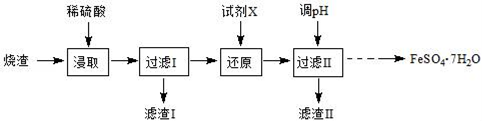
(1)滤渣Ⅰ的主要成分是_________ (填化学式)。
(2)还原时,试剂X若选用SO2,则反应后的阴离子是_________ (填化学式)。
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是_________ 、_________ 、过滤、洗涤、干燥。
(4)七水合硫酸亚铁(FeSO4•7H2O) 在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应),发生的反应为: +5Fe2++8H+=5Fe3++Mn2++4H2O;
+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要_________ 、_________ 。
②该补血剂中亚铁离子的含量为_________ mg/片。

(1)滤渣Ⅰ的主要成分是
(2)还原时,试剂X若选用SO2,则反应后的阴离子是
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是
(4)七水合硫酸亚铁(FeSO4•7H2O) 在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应),发生的反应为:
 +5Fe2++8H+=5Fe3++Mn2++4H2O;
+5Fe2++8H+=5Fe3++Mn2++4H2O;步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要
②该补血剂中亚铁离子的含量为
您最近一年使用:0次



