1 . 实验室探究化合物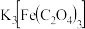 受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。回答下列问题:
受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。回答下列问题:
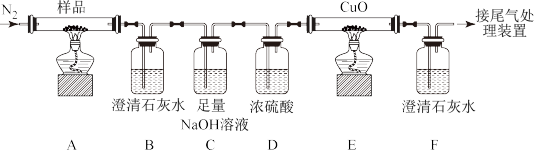
(1)实验开始时,缓缓通入氮气一段时间后,应先加热反应管E,后加热反应管A,原因是_______ 。
(2)待反应完全后,停止加热,仍持续不断地通入氮气,直至反应管冷却到室温。停止加热时,不需要先断开A、B的连接处和E、F的连接处,原因是_______ 。
(3)足量NaOH溶液的作用是_______ 。NaOH的电子式为_______ 。
(4)能证明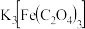 分解产物中有CO气体生成的实验现象是
分解产物中有CO气体生成的实验现象是_______ 。
(5)充分反应后,A中所得黑色粉末经检测为Fe和FeO的混合物。取该黑色粉末4.4g,溶于过量稀硝酸中,收集到标准状况下NO气体1.12L。该黑色粉末中,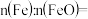
_______ 。
(6) 和
和 、
、 反应可制得
反应可制得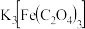 。已知常温下
。已知常温下 和
和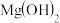 的Ksp分别为
的Ksp分别为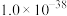 、
、 。常温下浓度均为
。常温下浓度均为 的
的 、
、 的混合溶液中,要使
的混合溶液中,要使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 时,即可认为该离子已沉淀完全)而
时,即可认为该离子已沉淀完全)而 不沉淀,应该调节溶液的pH的范围为
不沉淀,应该调节溶液的pH的范围为_______ 。
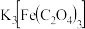 受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。回答下列问题:
受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。回答下列问题:
(1)实验开始时,缓缓通入氮气一段时间后,应先加热反应管E,后加热反应管A,原因是
(2)待反应完全后,停止加热,仍持续不断地通入氮气,直至反应管冷却到室温。停止加热时,不需要先断开A、B的连接处和E、F的连接处,原因是
(3)足量NaOH溶液的作用是
(4)能证明
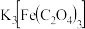 分解产物中有CO气体生成的实验现象是
分解产物中有CO气体生成的实验现象是(5)充分反应后,A中所得黑色粉末经检测为Fe和FeO的混合物。取该黑色粉末4.4g,溶于过量稀硝酸中,收集到标准状况下NO气体1.12L。该黑色粉末中,
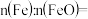
(6)
 和
和 、
、 反应可制得
反应可制得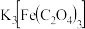 。已知常温下
。已知常温下 和
和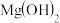 的Ksp分别为
的Ksp分别为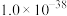 、
、 。常温下浓度均为
。常温下浓度均为 的
的 、
、 的混合溶液中,要使
的混合溶液中,要使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 时,即可认为该离子已沉淀完全)而
时,即可认为该离子已沉淀完全)而 不沉淀,应该调节溶液的pH的范围为
不沉淀,应该调节溶液的pH的范围为
您最近半年使用:0次
2022-08-08更新
|
179次组卷
|
2卷引用:河北省普通高中2023届高二学业水平选择性考试(一)化学试题
2 . 高纯超细氧化铝粉是一种新型无机功能材料,以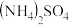 和
和 为原料制备复盐硫酸铝铵晶体[
为原料制备复盐硫酸铝铵晶体[ ],将硫酸铝铵晶体热分解可制得高纯超细氧化铝粉,其流程如下:
],将硫酸铝铵晶体热分解可制得高纯超细氧化铝粉,其流程如下:

回答下列问题:
(1)操作①需加入适量稀硫酸,其目的是_______ ,采用的纯化方法为_______ 。
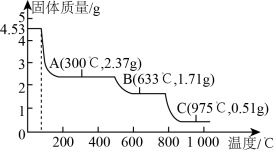
(2)取 加热分解,加热过程中固体质量随温度的变化如图所示。硫酸铝铵晶体在633℃、975℃分解生成的固体分别为
加热分解,加热过程中固体质量随温度的变化如图所示。硫酸铝铵晶体在633℃、975℃分解生成的固体分别为_______ 、_______ 。(填化学式)
(3)实验室以 和
和 为原料,在一定条件下反应生成制备纳米
为原料,在一定条件下反应生成制备纳米 的前驱体
的前驱体 沉淀,同时生成
沉淀,同时生成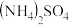 、
、 和
和 。
。 高温分解即得超细氧化铝粉。反应生成
高温分解即得超细氧化铝粉。反应生成 沉淀的化学方程式为
沉淀的化学方程式为_______ 。
(4)为了测定高纯超细氧化铝粉中 的质量分数,可用EDTA标准溶液滴定。取0.2035g高纯超细氧化铝粉溶于盐酸,加入过量的30.00mL0.1600
的质量分数,可用EDTA标准溶液滴定。取0.2035g高纯超细氧化铝粉溶于盐酸,加入过量的30.00mL0.1600 EDTA标准溶液并加热煮沸,充分反应后,再用
EDTA标准溶液并加热煮沸,充分反应后,再用 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液。已知
标准溶液。已知 、
、 与EDTA反应的化学计量数之比均为1:1。
与EDTA反应的化学计量数之比均为1:1。
①加入过量的EDTA标准溶液并加热煮沸,其原因是_______ 。
②高纯超细氧化铝粉中, 的质量分数为
的质量分数为_______ %(保留1位小数)。
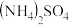 和
和 为原料制备复盐硫酸铝铵晶体[
为原料制备复盐硫酸铝铵晶体[ ],将硫酸铝铵晶体热分解可制得高纯超细氧化铝粉,其流程如下:
],将硫酸铝铵晶体热分解可制得高纯超细氧化铝粉,其流程如下:
回答下列问题:
(1)操作①需加入适量稀硫酸,其目的是
(2)取
 加热分解,加热过程中固体质量随温度的变化如图所示。硫酸铝铵晶体在633℃、975℃分解生成的固体分别为
加热分解,加热过程中固体质量随温度的变化如图所示。硫酸铝铵晶体在633℃、975℃分解生成的固体分别为
(3)实验室以
 和
和 为原料,在一定条件下反应生成制备纳米
为原料,在一定条件下反应生成制备纳米 的前驱体
的前驱体 沉淀,同时生成
沉淀,同时生成 、
、 和
和 。
。 高温分解即得超细氧化铝粉。反应生成
高温分解即得超细氧化铝粉。反应生成 沉淀的化学方程式为
沉淀的化学方程式为(4)为了测定高纯超细氧化铝粉中
 的质量分数,可用EDTA标准溶液滴定。取0.2035g高纯超细氧化铝粉溶于盐酸,加入过量的30.00mL0.1600
的质量分数,可用EDTA标准溶液滴定。取0.2035g高纯超细氧化铝粉溶于盐酸,加入过量的30.00mL0.1600 EDTA标准溶液并加热煮沸,充分反应后,再用
EDTA标准溶液并加热煮沸,充分反应后,再用 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液。已知
标准溶液。已知 、
、 与EDTA反应的化学计量数之比均为1:1。
与EDTA反应的化学计量数之比均为1:1。①加入过量的EDTA标准溶液并加热煮沸,其原因是
②高纯超细氧化铝粉中,
 的质量分数为
的质量分数为
您最近半年使用:0次
2022-08-08更新
|
238次组卷
|
2卷引用:河北省普通高中2023届高二学业水平选择性考试(一)化学试题
名校
解题方法
3 . 某课外小组研究NH4Cl与CuO反应,进行如下实验(部分装置略):
资料:Cu(NH3) ⇌Cu2++4NH3
⇌Cu2++4NH3
(1)实验Ⅰ中,固体部分溶解的原因是_______ (用化学用语解释)。该小组同学预测蓝色溶液中可能存在Cu(NH3) 。
。
①Cu(NH3) 中,Cu2+与NH3形成的化学键称为
中,Cu2+与NH3形成的化学键称为_______ ,提供孤电子对的成键原子是_______ 。
②设计实验方案验证蓝色溶液中存在Cu(NH3) 。
。______
(2)实验Ⅱ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:

对物质X,做出如下假设:
ⅰ.X是NH4Cl,由CuCl2生成CuCl的化学反应方程式是_______ 。
ⅱ.X是_______ ,理由是_______ 。
(3)实验Ⅰ过程中未观察到氧化还原反应的产物,实验Ⅱ反应过程中有氧化还原反应发生。反应不同可能的原因是_______ 。
| 实验 | Ⅰ | Ⅱ |
| 装置 | 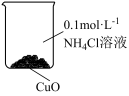 |  |
| 现象 | 向CuO粉末中加入0.1mol·L−1NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色 | 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色 |
 ⇌Cu2++4NH3
⇌Cu2++4NH3(1)实验Ⅰ中,固体部分溶解的原因是
 。
。①Cu(NH3)
 中,Cu2+与NH3形成的化学键称为
中,Cu2+与NH3形成的化学键称为②设计实验方案验证蓝色溶液中存在Cu(NH3)
 。
。(2)实验Ⅱ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:

对物质X,做出如下假设:
ⅰ.X是NH4Cl,由CuCl2生成CuCl的化学反应方程式是
ⅱ.X是
(3)实验Ⅰ过程中未观察到氧化还原反应的产物,实验Ⅱ反应过程中有氧化还原反应发生。反应不同可能的原因是
您最近半年使用:0次
2022-06-11更新
|
310次组卷
|
2卷引用:北京市顺义区杨镇第一中学2023届第零次模拟考试化学试题
名校
解题方法
4 . 以含钴废渣(主要成分为CoO和Co2O3,含少量Al2O3和ZnO)为原料制备锂电池的电极材料CoCO3的工艺流程如下:
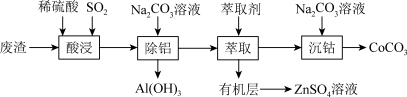
下列说法正确的是

下列说法正确的是
A.通入 发生反应的离子方程式:2Co3++SO2+4OH-=2Co2++SO 发生反应的离子方程式:2Co3++SO2+4OH-=2Co2++SO +2H2O +2H2O |
| B.前后两次加入Na2CO3溶液的目的相同,反应后溶液的pH也相同 |
| C.若萃取剂的总量一定,则一次加入萃取比分多次加入萃取效果更好 |
| D.将含Na2CO3的溶液缓慢滴加到Co2+溶液中沉钴,目的是防止产生Co(OH)2 |
您最近半年使用:0次
2022-03-03更新
|
424次组卷
|
3卷引用:河北省2022届普通高中学业水平选择性考试仿真模拟卷(一)化学试题
河北省2022届普通高中学业水平选择性考试仿真模拟卷(一)化学试题辽宁省沈阳市第二中学2023届高三第五次模拟考试化学试题(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编
名校
解题方法
5 . 下列离子方程式能用来解释相应实验现象的是
| 选项 | 实验现象 | 离子方程式 |
| A | 氢氧化亚铁溶于稀硝酸 |  |
| B | 向氢氧化镁悬浊液中滴加硫酸铵溶液,沉淀溶解 | 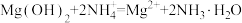 |
| C | 二氧化硫使酸性高锰酸钾溶液褪色 | 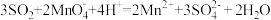 |
| D | 将新制氯水滴入含有酚酞的NaOH溶液中,溶液红色褪去 |  |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-03-03更新
|
898次组卷
|
3卷引用:河北省2022届普通高中学业水平选择性考试仿真模拟卷(一)化学试题
名校
解题方法
6 . 已知 在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
 在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是| pH范围 | >7 | <7 |
| 产物 |  | NO、 、 、 中的一种 中的一种 |
A.碱性条件下, 与NaClO反应的离子方程式为 与NaClO反应的离子方程式为 |
B.向冷的 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
C.向冷的 溶液中通入 溶液中通入 可得到 可得到 |
D.低温时不用其它试剂即可区分 溶液与 溶液与 溶液 溶液 |
您最近半年使用:0次
2021-10-28更新
|
84次组卷
|
8卷引用:辽宁省葫芦岛一中2017-2018学年高二下学期3月期初考试化学试卷
名校
解题方法
7 . 氨气可作为脱硝剂。回答下列问题:
(1)在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:_______NO(g)+_______NH3(g)⇌_______N2(g)+_______H2O(g)。____
①不能说明该反应已达到平衡状态标志的是_______ (填标号)。
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
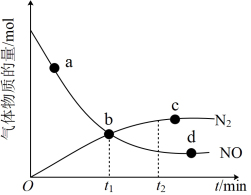
②某次实验中测得容器内NO及N2的物质的量随时间的变化如图所示,图中b点对应的反应速率关系是v正_______ v逆(填“ ” “
” “ ”或“
”或“ ”)。
”)。
(2)一定温度下,在2 L恒容密闭容器内发生反应2NO2(g)⇌N2O4(g),n(NO2)随时间的变化如表:
①0~2s内,该反应的平均速率v(NO2)=_______ 。
②根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是_______ 。
③该温度下,反应2NO2(g)⇌N2O4(g)的平衡常数K=_______ L·mol-1。
(3)对于反应2NO2(g)⇌N2O4(g),用平衡时各组分压强关系表达的平衡常数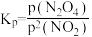 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
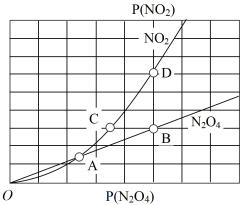
一定温度下,k1、k2与平衡常数KP的关系是k1=_______ 。在图标出的点中,指出能表示反应达到平衡状态的点并说明理由_______ 。
(1)在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:_______NO(g)+_______NH3(g)⇌_______N2(g)+_______H2O(g)。
①不能说明该反应已达到平衡状态标志的是
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间的变化如图所示,图中b点对应的反应速率关系是v正
 ” “
” “ ”或“
”或“ ”)。
”)。
(2)一定温度下,在2 L恒容密闭容器内发生反应2NO2(g)⇌N2O4(g),n(NO2)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2) /mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
②根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是
③该温度下,反应2NO2(g)⇌N2O4(g)的平衡常数K=
(3)对于反应2NO2(g)⇌N2O4(g),用平衡时各组分压强关系表达的平衡常数
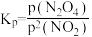 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
一定温度下,k1、k2与平衡常数KP的关系是k1=
您最近半年使用:0次
名校
8 . 某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。已知在溶液中:FeSO4+NO⇌Fe(NO)]SO4(棕色),该反应可用于检验NO。
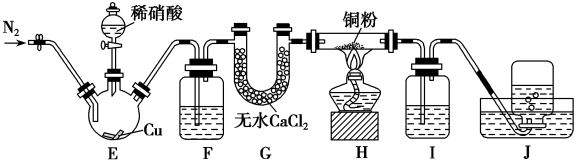
(1)实验开始前,向装置中通入一段时间的N2,目的是_______ 。
(2)盛装Cu片的仪器名称叫_______ ,请写出装置E中反应的离子方程式_______ 。
(3)装置F中盛放的是水,作用是_______ ;装置Ⅰ中盛放的试剂是_______ ,作用是_______ 。
(4)若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式:_______ 。

(1)实验开始前,向装置中通入一段时间的N2,目的是
(2)盛装Cu片的仪器名称叫
(3)装置F中盛放的是水,作用是
(4)若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式:
您最近半年使用:0次
2021-07-02更新
|
1337次组卷
|
6卷引用:四川省成都七中(高新校区)2020-2021学年高二下学期期末零诊模拟化学试题
9 . 镍行业发展蕴藏着巨大的潜力。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下:

已知:①Ksp(CaF2)=1.6×10-10、Ksp[Fe(OH)2]=8.0×10-16、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=2.7×10-34;
②认为残留在溶液中的离子浓度小于1×10-5mol/L即沉淀完全。
(1)“粉碎”的目的是___________ 。滤渣Ⅰ的成分有___________ (化学式)。
(2)在“调pH”过程中,应先加入H2O2,发生反应的离子方程式为___________ ,沉淀剂可选择___________ 。(填序号)
a.NiOb.NaOHc.Ni(OH)2d.NiCO3
为将Al3+、Fe3+沉淀完全,至少应调节pH到___________ (已知lg3≈0.5)。
(3)在“沉淀”过程中,Ca2+刚好沉淀完全时,溶液中c(F-)=___________ mol/L。
(4)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍,且还生成一种气体,请写出该制备过程的化学方程式:___________ 。

已知:①Ksp(CaF2)=1.6×10-10、Ksp[Fe(OH)2]=8.0×10-16、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=2.7×10-34;
②认为残留在溶液中的离子浓度小于1×10-5mol/L即沉淀完全。
(1)“粉碎”的目的是
(2)在“调pH”过程中,应先加入H2O2,发生反应的离子方程式为
a.NiOb.NaOHc.Ni(OH)2d.NiCO3
为将Al3+、Fe3+沉淀完全,至少应调节pH到
(3)在“沉淀”过程中,Ca2+刚好沉淀完全时,溶液中c(F-)=
(4)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍,且还生成一种气体,请写出该制备过程的化学方程式:
您最近半年使用:0次
2021-02-08更新
|
341次组卷
|
3卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
解题方法
10 . 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ∆H1
CO(g)+H2O(g)===CO2(g)+H2(g) ∆H2
2CO(g)+O2(g)===2CO2(g) ∆H3
则CO2(g)+CH4(g)===2CO(g)+2H2(g)的∆H=____________ 。
(2)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式_________________ 。
(3)用盐酸作甲醇燃料电池的电解质正在成为热点课题。甲醇可以用一氧化碳与氢气反应生成(催化剂为Cu2O/ZnO)。已知:2CO(g) +O2(g) 2CO2(g) △H = -566 kJ• mol-1
2CO2(g) △H = -566 kJ• mol-1
CH3OH(g)+ O2(g)
O2(g)  CO2(g) +2H2(g) △H = -182.9 kJ • mol-1
CO2(g) +2H2(g) △H = -182.9 kJ • mol-1
则 CO(g) +2H2(g) CH3OH(g) △H =
CH3OH(g) △H = ______ 。
若将生成的CH3OH与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为__________ 。
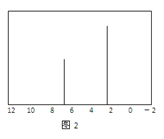
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如图2所示,则X的结构简式为_________ 。
(5)科学家用氮化镓材料与铜组装如右图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
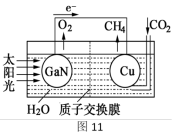
①写出铜电极表面的电极反应式_________ 。
②为提高该人工光合系统的工作效率,可向装置中加入少量_______ (选填“盐酸”或“硫酸”)。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ∆H1
CO(g)+H2O(g)===CO2(g)+H2(g) ∆H2
2CO(g)+O2(g)===2CO2(g) ∆H3
则CO2(g)+CH4(g)===2CO(g)+2H2(g)的∆H=
(2)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式
(3)用盐酸作甲醇燃料电池的电解质正在成为热点课题。甲醇可以用一氧化碳与氢气反应生成(催化剂为Cu2O/ZnO)。已知:2CO(g) +O2(g)
 2CO2(g) △H = -566 kJ• mol-1
2CO2(g) △H = -566 kJ• mol-1CH3OH(g)+
 O2(g)
O2(g)  CO2(g) +2H2(g) △H = -182.9 kJ • mol-1
CO2(g) +2H2(g) △H = -182.9 kJ • mol-1则 CO(g) +2H2(g)
 CH3OH(g) △H =
CH3OH(g) △H = 若将生成的CH3OH与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如图2所示,则X的结构简式为

(5)科学家用氮化镓材料与铜组装如右图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。

①写出铜电极表面的电极反应式
②为提高该人工光合系统的工作效率,可向装置中加入少量
您最近半年使用:0次



